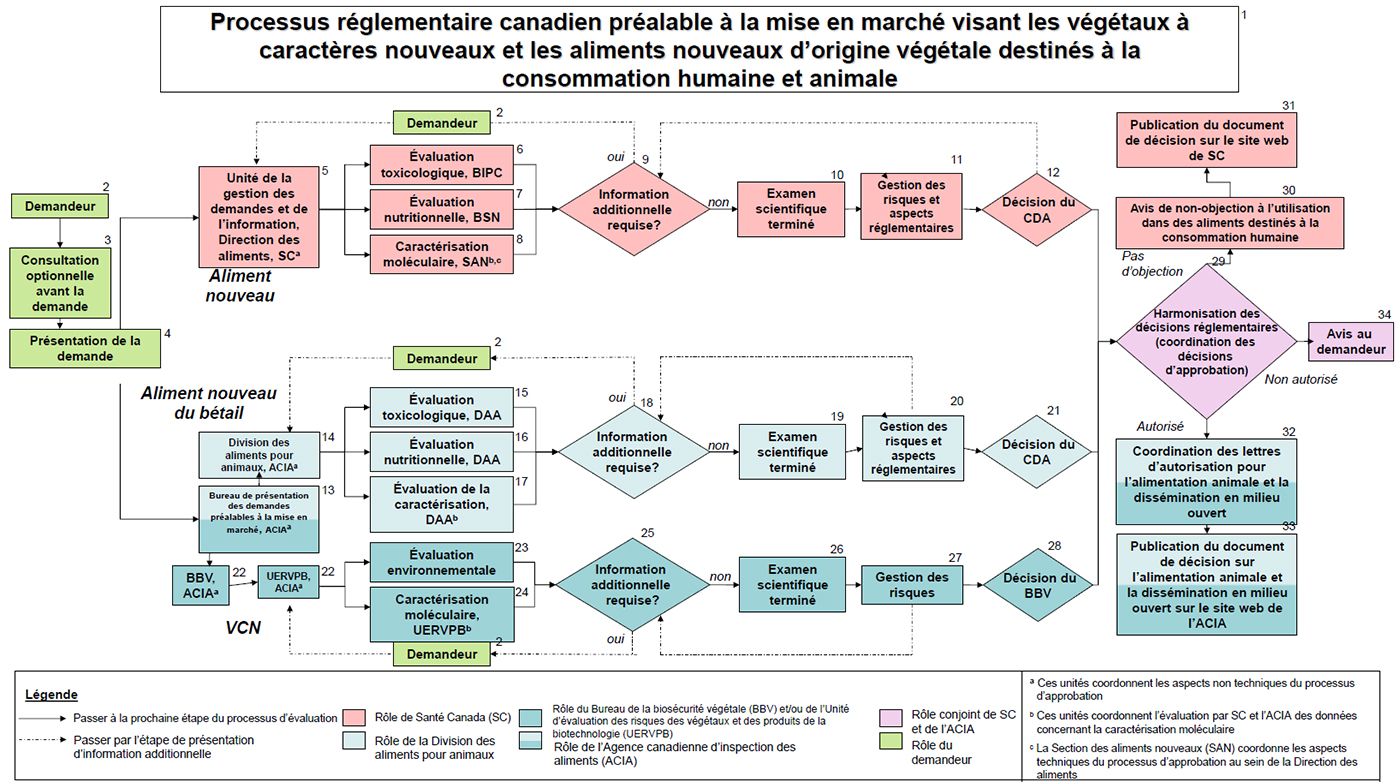
Processus réglementaire canadien préalable à la mise en marché visant les végétaux à caractères nouveaux et les aliments nouveaux d'origine végétale destinés à la consommation humaine et animale
L'information contenue dans le schéma qui l'accompagne est destinée aux personnes qui souhaitent mieux comprendre le processus réglementaire visant les végétaux à caractères nouveaux (VCN) et les aliments nouveaux d'origine végétale destinés à la consommation humaine et animale.
Le schéma donne un aperçu visuel du processus, tandis que l'information dans les descriptions associées élabore sur les différentes étapes qui s'y trouvent. Il convient de mentionner que le schéma et le présent document s'appliquent aux produits qui sont considérés comme étant à la fois des végétaux à caractères nouveaux, des aliments d'origine végétale et des aliments pour animaux d'origine végétale.
Schéma du processus
Cliquer pour agrandir l'image
Acronymes
- ACIA
- Agence canadienne d'inspection des aliments
- BBV
- Bureau de la biosécurité végétale, ACIA
- BDM
- Bureau des dangers microbiens, Direction des aliments, SC
- BIPC
- Bureau d'innocuité des produits chimiques, Direction des aliments, SC
- BPDPM
- Bureau de présentation des demandes préalables à la mise en marché, ACIA
- BSN
- Bureau des sciences de la nutrition, Direction des aliments, SC
- CDA
- Comité des décisions sur les aliments, Direction des aliments, SC
- DAA
- Division des aliments pour animaux, ACIA
- SAN
- Section des aliments nouveaux, BDM
- SC
- Santé Canada
- UERVPB
- Unité d'évaluation des risques des végétaux et des produits de la biotechnologie, ACIA
- UGDI
- Unité de la gestion des demandes et de l'information, SC
- VCN
- Végétal à caractère nouveau
Consultation optionnelle avant une demande et soumission de la demande
1. Processus réglementaire canadien préalable à la mise en marché visant les végétaux à caractères nouveaux et les aliments nouveaux d'origine végétale destinés à la consommation humaine et animale
Ce schéma présente de l'information générale sur les étapes du processus suivi par le gouvernement du Canada pour l'examen des demandes visant les VCN et les aliments nouveaux d'origine végétale destinés à l'alimentation humaine et animale et ne s'applique pas aux aliments nouveaux d'autres origines.
À des fins de simplification, les étapes du processus réglementaire qui ne s'appliquent pas spécifiquement aux VCN et aux aliments nouveaux d'origine végétale destinés à l'alimentation humaine et animale ne figurent pas dans le schéma. Par exemple, les aliments nouveaux destinés à la consommation humaine et animale peuvent nécessiter un examen additionnel en lien avec des allégations concernant la santé ou l'efficacité durant la phase d'évaluation et après l'approbation; d'autre part, les VCN peuvent être assujettis à l'enregistrement des variétés.
2. Demandeur
Le demandeur est l'entité qui présente le produit nouveau dans le cadre réglementaire canadien. Les termes « demandeur » et « requérant » sont interchangeables. Le demandeur peut être, par exemple, un phytogénéticien, un importateur ou le fabricant du produit.
En vertu de la Loi relative aux aliments du bétail et de la Loi sur les aliments et drogues, le demandeur doit avoir la citoyenneté canadienne ou avoir un agent canadien qui assumera la responsabilité légale du produit nouveau. Un agent canadien n'est toutefois pas requis aux fins de l'autorisation de dissémination dans l'environnement.
Il incombe aussi au demandeur de considérer le caractère nouveau du produit selon la Loi relative aux aliments du bétail, la Loi sur les semences et la Loi sur les aliments et drogues, et d'identifier son produit auprès des organismes de réglementation appropriés. S'il a des doutes quant au caractère nouveau du produit, le demandeur peut s'adresser à Santé Canda (SC) et à l'Agence canadienne d'inspection des aliments (ACIA), qui offrent un service de consultation optionnel à ce sujet.
Si le demandeur doit fournir de l'information additionnelle pour compléter l'évaluation de la salubrité du produit ou des risques qu'il pose pour l'environnement (voir les cases 9, 18 et 25), le demandeur répond en communiquant directement avec l'Unité de la gestion des demandes et de l'information (si la demande vient de SC) ou avec les évaluateurs de risques (si la demande vient de l'ACIA).
Afin de protéger les renseignements commerciaux confidentiels du demandeur, la Division des aliments pour animaux (DAA) de l'ACIA demande au requérant de lui fournir une liste des personnes ayant un pouvoir de signature au sein de son organisation. Seules les personnes dont le nom figure sur cette liste seront autorisées à signer les demandes, à discuter des demandes et à correspondre avec la DAA.
3. Consultation optionnelle avant une demande
Une consultation préalable, une étape optionnelle du cadre réglementaire actuel, est offerte pour permettre aux demandeurs de discuter de leur produit avec les agents des organismes de réglementation avant de présenter une demande. La consultation préalable permet au demandeur :
- de présenter un aperçu de sa demande;
- de poser des questions précises sur le contenu de celle-ci;
- d'obtenir des éclaircissements sur les exigences concernant les données ou l'information à fournir sur le produit;
- de clarifier les exigences réglementaires, les politiques et les processus administratifs le cas échéant;
- de clarifier les attentes relatives à la qualité des données, leur pertinence et leur utilisation; et
- à l'élaboration des justifications scientifiques
Cette consultation réduit souvent le nombre de demandes d'éclaircissements ou d'informations additionnelles faites par les organismes de réglementation afin de compléter leur évaluation et de prendre une décision. SC et l'ACIA ont mis au point un document d'orientation destiné aux nouveaux demandeurs. Ce document est accessible sur la page consacrée aux Procédures de consultation préalable concernant les aliments et les aliments du bétail nouveaux et les végétaux à caractères nouveaux ou en communiquant avec les entités dont les coordonnées figurent ci-dessous.
Les demandeurs qui souhaitent consulter les organismes de réglementation avant de présenter leur demande doivent communiquer avec SC ou avec l'ACIA pour organiser une réunion de consultation préalable. Les évaluateurs de tous les groupes pertinents seront présents, peu importe l'organisme auquel la demande de consultation est faite (SC ou ACIA) :
Dans le cas des aliments nouveaux :
Unité de la gestion des demandes et de l'information
Direction des aliments, Direction générale des produits de santé et des aliments,
Santé Canada
251, promenade Sir Frederick Banting
Indice de l'adresse : 2202E
Ottawa (Ontario) K1A 0K9
Téléphone : 613-960-0552
Télécopieur : 613-946-4590
Courriel : smiu-ugdi@hc-sc.gc.ca
Dans le cas des VCN et des aliments nouveaux du bétail :
Bureau de présentation des demandes préalables à la mise en marché
Agence canadienne d'inspection des aliments
59, promenade Camelot
Ottawa (Ontario) K1A 0Y9
Site Web : Bureau de présentation des demandes préalables à la mise en marché
Courriel : cfia.paso-bpdpm.acia@inspection.gc.ca
4. Présentation des demandes d'évaluation
Le demandeur doit présenter trois demandes distinctes pour l'évaluation d'un produit qui est à la fois un VCN, un aliment nouveau d'origine végétale et un aliment nouveau du bétail d'origine végétale:
- une demande au Bureau de la biosécurité végétale (BBV) pour la dissémination du VCN en milieu ouvert
- une demande à la DAA pour l'utilisation comme aliment pour les animaux
- une demande à la Section des aliments nouveaux (SAN) de SC pour l'évaluation de la salubrité en alimentation humaine
En vertu de la partie V du Règlement sur les semences, le BBV de l'ACIA est responsable de la réglementation des VCN au Canada sur le plan de leurs risques pour l'environnement. Un végétal à caractère nouveau est un végétal qui présente un caractère à la fois nouveau pour l'environnement canadien et susceptible de modifier l'utilisation du végétal d'origine ou de compromettre son innocuité sur le plan de l'environnement et de la santé humaine. Les caractères nouveaux peuvent être introduits par différentes techniques, y compris le génie génétique, la mutagénèse et la sélection conventionnelle.
Avant d'autoriser la dissémination d'un VCN en milieu ouvert, on doit déterminer le risque qu'il présente pour l'environnement. Les critères utilisés pour évaluer les VCN en vue de leur dissémination dans l'environnement sont décrits dans la Directive 94-08 – Critères d'évaluation du risque environnemental associé aux végétaux à caractères nouveaux de l'ACIA.
La DAA de l'ACIA réglemente tous les aliments destinés aux animaux, y compris ceux qui sont nouveaux, en vertu de la Loi relative aux aliments du bétail et de son règlement. Tous les ingrédients nouveaux utilisés dans les aliments pour les animaux, y compris les ingrédients d'origine végétale, sont évalués et réglementés de la même façon. Tout nouvel ingrédient (c'est-à-dire, non mentionné dans le Règlement sur les aliments du bétail) ou tout ingrédient qui a été modifié de telle sorte qu'il diffère de beaucoup d'un ingrédient traditionnel doit faire l'objet d'une évaluation préalable à la mise en marché et d'une approbation.
Toutes les évaluations des aliments pour animaux ont le même objectif, c'est-à-dire s'assurer, avant leur mise en marché, que les ingrédients qu'ils renferment sont sûrs (sur le plan de la santé des animaux, de la santé humaine [en raison des résidus possibles et de l'exposition professionnelle/fortuite] et de l'environnement) et efficaces par rapport à leur usage prévu.
L'évaluation permet également de s'assurer que les aliments pour animaux sont définis avec exactitude dans le Règlement sur les aliments du bétail et qu'ils sont étiquetés de façon appropriée pour indiquer leur innocuité et leur efficacité ainsi que pour protéger les consommateurs. De l'information sur les critères utilisés pour évaluer les aliments nouveaux destinés aux animaux est offerte dans les Directives relatives à l'évaluation des aliments nouveaux du bétail : origine végétale, qui correspondent à la section 2.6 des « Directives Réglementaires : Procédures d'enregistrement et normes d'étiquetage » de la DAA.
Santé Canada (SC) a pour responsabilité de vérifier que tous les aliments nouveaux sont sûrs avant qu'ils n'entrent dans le système d'approvisionnement alimentaire canadien. En vertu du titre 28 du Règlement sur les aliments et drogues, une organisation qui désire vendre un aliment nouveau doit aviser SC avant de le mettre en marché ou d'en faire la publicité. De l'information sur les critères utilisés pour évaluer les aliments nouveaux est offerte dans les Lignes directrices sur l'évaluation de l'innocuité des aliments nouveaux de SC.
Aliment nouveau, SC
5. Unité de la gestion des demandes et de l'information de la Direction des aliments, SC
L'Unité de la gestion des demandes et de l'information (UGDI) est responsable de communiquer avec les demandeurs, de recevoir tous les préavis de mise en marché et de suivre les progrès de ceux-ci, y compris de ceux qui concernent les aliments nouveaux d'origine végétale; elle reçoit et suit également les autres demandes soumises à la Direction des aliments (à l'exclusion des demandes qui visent les produits de santé naturels sous forme d'aliments, l'emballage et les additifs indirects). Il s'agit donc d'un guichet unique pour l'examen des demandes.
L'UGDI distribue ensuite les demandes au Bureau d'innocuité des produits chimiques (BIPC), au Bureau des sciences de la nutrition (BSN) et au Bureau des dangers microbiens (BDM).
6. Évaluation toxicologique du BIPC, SC
Le BIPC est responsable de l'évaluation des aspects chimiques, toxicologiques et allergiques.
7. Évaluation nutritionnelle du BSN, SC
Le BSN est responsable de l'évaluation des aspects nutritionnels, y compris de l'examen des données sur la composition des aliments nouveaux par rapport à leur homologue traditionnel.
8. Caractérisation moléculaire de la SAN, SC
La SAN du BDM est responsable de l'évaluation des aspects génétiques et microbiens. Elle assure également la coordination des aspects techniques de l'évaluation de l'innocuité préalable à la mise en marché entre les trois bureaux de la Direction des aliments.
9. Information additionnelle requise, SC
Si, après l'examen de l'information présentée, les bureaux ont des questions ou exigent des éclaircissements, l'UGDI (ou la SAN) envoie au demandeur une lettre en leur nom qui décrira les questions auxquelles celui-ci doit répondre ou les éclaircissements qu'il doit apporter.
10. Examen scientifique terminé, SC
Les exigences concernant l'information à fournir ont été satisfaites, ainsi que toutes les demandes d'éclaircissements ou d'informations additionnelles.
11. Gestion des risques et aspects réglementaires, SC
Selon les résultats de l'évaluation de l'innocuité, des recommandations peuvent être faites relativement à la gestion des risques; on s'assure également que les autres aspects réglementaires applicables sont respectés.
12. Décision du Comité des décisions sur les aliments, SC
Lorsque l'évaluation de l'innocuité est terminée, on élabore un document résumant les examens scientifiques menés par les bureaux de la Direction des aliments. Dans le cas des aliments nouveaux d'origine végétale, le résumé est rédigé par la SAN et présenté au Comité des décisions sur les aliments (CDA) qui l'étudie puis prend une décision. Ce Comité est présidé par le directeur général de la Direction des aliments et formé de cadres supérieurs de cette direction ainsi que de représentants de l'ACIA (Remarque : la composition du CDA peut changer selon les aliments nouveaux qui sont proposés).
Lorsque les examens scientifiques menés par les Bureaux concluent que le produit ne peut pas être considéré comme un aliment sûr, cette conclusion est aussi présentée au CDA. En outre, lorsque les demandeurs ne sont pas en mesure de fournir une justification scientifique valide ou les données requises pour tirer une conclusion au sujet de l'innocuité d'un produit, ils peuvent choisir de retirer leur demande avant la présentation au CDA.
Aliment nouveau du bétail, ACIA
13. Bureau de présentation des demandes préalables à la mise en marché, ACIA
Le Bureau de présentation des demandes préalables à la mise en marché (BPDPM) est le guichet unique pour la présentation à l'ACIA des demandes visant les VCN et les aliments nouveaux du bétail d'origine végétale, ainsi que les autres types de demandes visant les végétaux et les aliments pour animaux. Le BPDPM a entre autres pour but de promouvoir la cohérence des fonctions administratives des différents programmes. Sur réception d'une demande visant un aliment nouveau destiné au bétail ou la dissémination d'un VCN dans l'environnement, le BPDPM assure les tâches administratives de base, puis transmet les dossiers à la DAA ou au BBV, respectivement.
La DAA fait ensuite un examen préliminaire du dossier pour vérifier que toute l'information nécessaire a été fournie, prend une décision quant à l'acceptation du dossier et communique celle-ci au BPDPM. Ce dernier complète ensuite les tâches administratives restantes. Si le dossier est accepté, il est ajouté à la liste d'attente et remis aux agents d'évaluation de la DAA auxquels il a été assigné.
14. Division des aliments pour animaux, ACIA
Les données sont reçues par un administrateur de la DAA qui les distribue aux évaluateurs désignés. Chaque évaluateur étudie la demande selon sa propre expertise (par exemple, nutrition animale, toxicologie, biologie moléculaire), mais tous les évaluateurs travaillent en collaboration en vue d'évaluer la demande et de prendre une décision concernant l'autorisation.
15. Évaluation toxicologique, DAA
La DAA évalue la toxicité et le potentiel allergène du nouvel aliment du bétail, compte tenu de l'exposition du bétail, du transfert de contaminants aux aliments d'origine animale et de l'exposition professionnelle/fortuite.
16. Évaluation nutritionnelle, DAA
La DAA examine toute l'information présentée sur la composition nutritionnelle et anti-nutritionnelle du nouvel aliment du bétail en vue d'estimer sa salubrité et son efficacité nutritive. La DAA détermine aussi si cet aliment aura un impact sur les pratiques conventionnelles d'alimentation du bétail et évalue les allégations nutritionnelles associées à cet aliment.
17. Évaluation de la caractérisation, DAA
La DAA examine l'information présentée au sujet du développement et de la caractérisation du végétal à caractère nouveau ainsi que toute autre information présentée pour étayer son innocuité et son efficacité qui requiert une expertise en biologie moléculaire et en caractérisation des protéines.
L'agent d'évaluation chargé de l'évaluation de la caractérisation coordonne aussi les aspects techniques de l'évaluation d'innocuité préalable à la mise en marché entre les différentes disciplines de la DAA. Il joue également le rôle de personne-ressource auprès de SC et du BBV en vue de coordonner la décision finale concernant l'autorisation du végétal à caractère nouveau.
Il partage avec l'Unité d'évaluation des risques des végétaux et des produits de la biotechnologie (UERVPB) la responsabilité d'examiner, le cas échéant, la méthode de détection et d'identification des VCN et des nouveaux aliments du bétail d'origine végétale et, lorsque la décision finale concernant l'autorisation du VCN a été prise, la responsabilité de coordonner la rédaction du document de décision.
18. Information additionnelle requise, DAA
Si, après l'examen de l'information présentée, la DAA a des questions ou exige des éclaircissements, une lettre est envoyée au demandeur décrivant les questions auxquelles il doit répondre ou les éclaircissements qu'il doit fournir. Dans certains cas, par exemple s'il est possible que des résidus se trouvent dans les aliments produits à partir d'animaux ayant consommé un nouvel aliment d'origine végétale, la DAA peut demander l'opinion d'un organisme de réglementation approprié, comme Santé Canada.
19. Examen scientifique terminé, DAA
L'information présentée a été examinée par la DAA et le demandeur a répondu à toutes les demandes d'éclaircissements ou d'informations additionnelles. La DAA passe alors à l'étape de la prise de décision, y compris de la gestion des risques, en se fondant sur l'information disponible.
Si l'information est incomplète et ne pourra être fournie en temps opportun, ou si le demandeur est incapable de fournir les données probantes quant à l'innocuité et à l'efficacité de son produit, la DAA ne peut terminer son évaluation et le dossier est clos. La gestion des risques et les aspects réglementaires (voir ci-dessous) peuvent aussi être pris en considération durant l'examen scientifique. Voir la section 21.
20. Gestion des risques et aspects réglementaires, DAA
La gestion des risques consiste à imposer des conditions nécessaires à l'utilisation sûre et efficace d'un aliment nouveau du bétail, lesquelles ont été identifiées durant l'examen scientifique. Une gestion des risques n'est pas nécessaire aux aliments nouveaux du bétail qui répondent à une définition des annexes IV ou V du Règlement sur les aliments du bétail. La DAA évalue aussi si l'aliment nouveau du bétail d'origine végétale répond aux définitions et aux exigences énumérées à l'annexe IV du Règlement sur les aliments du bétail, ou s'il faut y ajouter une nouvelle définition ou modifier une définition existante pour le décrire.
21. Décision de la DAA, DAA
Lorsque chaque évaluateur de la DAA a terminé d'évaluer une demande en fonction de sa propre expertise, tous les évaluateurs impliqués collaborent pour prendre une décision concertée et fondée sur toutes les données probantes qui accompagnent la demande. Ils recommandent des options de gestion des risques si nécessaire.
Végétaux à caractères nouveaux, ACIA
22. Le BBV examine la demande et la soumet à l'UERVPB, ACIA
Le BBV coordonne le processus d'examen, détermine le niveau d'évaluation requis et sollicite les conseils scientifiques de l'UERVPB avant de prendre une décision au sujet du produit. Il détermine et impose également les conditions nécessaires pour gérer les risques associés aux produits.
23. Évaluation environnementale, UERVPB
L'UERVPB examine l'information sur le risque environnemental fournie au BBV par le demandeur conformément aux critères décrits dans la Directive 94-08, et rend un avis au BBV au sujet du produit.
L'UERVPB examine l'information selon les cinq piliers de l'évaluation du risque environnemental :
- risque accru de se comporter comme une mauvaise herbe/d'être envahissant
- risque de flux génétique et conséquences
- risque de devenir nuisible
- impacts potentiels sur les organismes non visés; impacts potentiels sur la biodiversité
Lorsque des risques sont identifiés durant le processus d'évaluation, l'UERVPB offre aussi des avis scientifiques sur la gestion de ces risques.
24. Caractérisation moléculaire, UERVPB
L'UERVPB effectue une caractérisation moléculaire du VCN (en collaboration avec l'Unité moléculaire de la DAA et le Bureau des dangers microbiens de SC).
25. Information additionnelle requise, UERVPB
Si, après l'examen de l'information présentée, l'UERVPB a des questions ou exige des éclaircissements, une lettre est envoyée au demandeur décrivant les questions auxquelles il doit répondre ou les éclaircissements qu'il doit fournir.
26. Examen scientifique terminé, UERVPB
Toutes les exigences concernant l'information à fournir ont été satisfaites et tous les éclaircissements et renseignements demandés ont été fournis.
27. Gestion des risques, BBV
La gestion des risques consiste à soumettre l'utilisation du VCN à certaines conditions de façon à atténuer les risques potentiels pour l'environnement qui ont été identifiés. Une gestion des risques n'est pas systématiquement requise ou appropriée, mais certains VCN (en particulier les VCN résistants aux insectes et tolérants aux herbicides) requièrent parfois un plan d'intendance. Ce rôle est partagé entre le BBV et l'UERVPB.
28. Décision du BBV, BBV
Compte tenu des avis scientifiques fournis par l'UERVPB et de tous les autres facteurs pertinents, le BBV a pour responsabilité de prendre une décision concernant l'autorisation de disséminer un VCN en milieu ouvert, ainsi que toutes les conditions de gestion des risques requises (par exemple, plans de gestion de la résistance aux insectes ou de la tolérance aux herbicides).
Décision réglementaire
29. Harmonisation des décisions réglementaires (Politique de coordination des décisions d'approbation), ACIA/SC
Lorsqu'un végétal est considéré comme un VCN, les décisions réglementaires concernant son utilisation dans l'alimentation humaine ou animale et concernant sa dissémination dans l'environnement sont coordonnées et harmonisées pour réduire au minimum le risque que des produits non approuvés se retrouvent dans l'environnement ou dans l'approvisionnement alimentaire humain ou animal au Canada. Une fois que les décisions réglementaires ont été harmonisées, l'ACIA et SC envoient chacun une lettre au demandeur et affichent un document de décision sur leur site web respectif.
30. Avis de non-objection à l'utilisation dans des aliments destinés à la consommation humaine, SC
Si le Comité juge acceptables la décision proposée et la conclusion que l'aliment est sûr, le demandeur est avisé par écrit que, suite à l'évaluation des données présentées, Santé Canada ne s'objecte pas à la vente de l'aliment nouveau au Canada tel que spécifié dans l'avis.
31. Publication du document de décision sur le site web de SC, SC
Par souci de transparence, tout en respectant les renseignements commerciaux confidentiels contenus dans la demande, un résumé est rédigé qui décrit le produit et résume l'information recueillie pour démontrer son innocuité.
Ce résumé est préparé conformément aux sections pertinentes des Lignes directrices :
- Développement et production
- Renseignements sur le produit
- Exposition alimentaire
- Examens nutritionnels et examens toxicologiques
Le demandeur a ensuite la possibilité de revoir le résumé et de faire des commentaires. Le document de décision sur l'aliment nouveau est ensuite publié sur la page du site web de Santé Canada consacrée aux aliments nouveaux.
32. Coordination des lettres d'autorisation pour l'alimentation animale et la dissémination en milieu ouvert, ACIA
Lorsqu'une décision réglementaire harmonisée autorisant la dissémination du VCN en milieu ouvert et son utilisation dans l'alimentation animale a été prise, des lettres d'autorisation sont envoyées au demandeur par le BBV et la DAA de l'ACIA. Ces lettres décrivent toutes les conditions liées aux autorisations.
33. Publication d'un document de décision conjoint concernant l'utilisation dans l'alimentation animale/dissémination en milieu ouvert sur le site web de l'ACIA, ACIA
Par souci de transparence, tout en respectant les renseignements commerciaux confidentiels contenus dans la demande, un résumé est rédigé qui décrit le produit et résume l'information évaluée lors de l'examen de la demande. Ce résumé est préparé conformément aux sections pertinentes des directives réglementaires applicables de l'ACIA. Le demandeur a ensuite la possibilité de revoir le résumé et de faire des commentaires. Le document de décision sur l'aliment nouveau du bétail/VCN est ensuite publié sur le site web de l'ACIA.
34. Avis au demandeur, ACIA/SC
Si la décision réglementaire harmonisée de l'ACIA et de SC est de ne pas autoriser la dissémination du VCN en milieu ouvert ou son utilisation dans l'alimentation humaine ou animale, une lettre expliquant cette décision est envoyée au demandeur par chaque entité.
D'autres renseignements du gouvernement et de l'industrie
- Bureau de présentation de demandes préalable à la mise en marché
- Végétaux à caractères nouveaux
- Approbations des aliments du bétail génétiquement modifiés
- Santé Canada - Aliments génétiquement modifiés et autres aliments nouveaux
- Date de modification :