RG-1 Directives réglementaires :
Chapitre 2 – Exigences par rapport aux données pour l'enregistrement des ingrédients et des aliments du bétail
Cette page fait partie du répertoire des documents d'orientation (RDO).
Vous cherchez des documents connexes?
Recherche de documents connexes dans le répertoire des documents d'orientation.
Sur cette page
-
2.1 Processus de simplification des approbations pour l'enregistrement des aliments du bétail de catégorie 1
- Exigences et liste de contrôle pour la simplification des approbations des aliments pour animaux de catégorie 1
- Annexe 1 – Exigences en matière d'étiquetage pour les changements nouveaux et importants apportés aux aliments mélangés standard énumérés aux articles 1 à 6 de l'annexe I, tableau 3, du Règlement de 1983 sur les aliments du bétail
- Annexe 2 – Exigences en matière d'étiquetage pour mélanges simples et les dilutions d'aliments pour animaux à ingrédient unique contenant uniquement des ingrédients figurant à l'annexe IV, partie I, classes 1 à 7.1
- 2.2 Exigences pour l'enregistrement des produits spécialisés
- 2.3 Exigences pour l'évaluation des ingrédients
- 2.4 Données générales nécessaire à l'évaluation de l'innocuité des ingrédients
-
2.5 Exigences en matière de données pour l'évaluation de la sécurité des produits : notes explicatives
- 1.0 Identification et utilisation du produit
- 2.0 Constituants chimiques, incluant les contaminants et les impuretés
- 3.0 Méthode(s) d'analyse, récupération et données relatives aux limites de détection des analyses
- 4.0 Données physico-chimiques
- 5.0 Données toxicologiques chez les mammifères
- 6.0 Limite maximale de résidus (LMR) ou tolérance suggérée
- 7.0 Données sur l'exposition humaine et estimation de l'exposition
- 8.0 Études sur les résidus et le devenir métabolique chez le bétail
- 9.0 Effets et devenir dans l'environnement
-
2.6 Directives relatives à l'évaluation des aliments nouveaux du bétail : origine végétale
- 1.0 Introduction
- 2.0 Caractérisation de la source végétale
- 3.0 Données nutritionnelles
- 4.0 Expositions alimentaires
- 5.0 Données toxicologiques
- 6.0 Données sur l'allergénicité
- 7.0 Essais alimentaires sur des animaux de ferme et/ou de laboratoire
- 8.0 Évaluation de l'innocuité pour l'environnement
- 9.0 Méthodes de détection et d'identification
- 10.0 Décision réglementaire
- 11.0 Publication de la décision
- 12.0 Besoin de nouveaux renseignements
- 13.0 Définitions
- 14.0 Références
- Annexe I : Exigences relatives à la caractérisation moléculaire des aliments du bétail à caractères nouveaux dérivés de végétaux mis au point à l'aide de techniques de l'ADN recombinant :
- Annexe II : Directive pour la détermination de la nouveauté
-
2.7 Directives relatives à l'évaluation des nouveaux aliments du bétail : produits d'origine microbienne
- 1 Introduction
- 2 Caractérisation du produit microbien
- 3 Inactivation des agents antimicrobiens dans les aliments pour animaux
- 4 Innocuité humaine et animale
- 5 Sécurité environnementale
- 6 Décision réglementaire
- 7 Exigences en matière de nouvelle information
- 8 Définitions
- Annexe I : Description des essais de toxicité, d'infectiosité et de pathogénicité
- Annexe II : Listes de vérification de données moléculaires
- Annexe III : Description des vecteurs
-
Figure 1 : Exemple d'une carte détaillée d'un vecteur plasmidique
(extrait de la demande de l'APHIS no 94-257-01p) - Références
- 2.8 Guide sur la transition d'une demande vers des données provenant d'une littérature publiquement accessible et des demandes d'aliments pour animaux précédemment approuvées
- 2.9 Flexibilité des données pour les paramètres de performance de production et les allégations associées
2.1 Processus de simplification des approbations pour l'enregistrement des aliments du bétail de catégorie 1
Objet
L'Agence canadienne d'inspection des aliments (ACIA) et l'industrie de l'alimentation animale continuent de chercher des moyens de simplifier les processus afin de réduire le temps total nécessaire à l'approbation des produits d'aliments pour animaux nécessitant un enregistrement.
Contexte
L'enregistrement des aliments pour animaux de catégorie 1 concerne des aliments standard qui ne nécessitent pas d'examen des données sur l'innocuité ou l'efficacité. Ses exigences sont assez simples et le procédé d'approbation est direct. Cependant l'évaluation de ces aliments peut prendre beaucoup de temps en raison du niveau de qualité des demandes et des interactions qui suivent pour s'assurer que tous les renseignements nécessaires à l'évaluation des produits sont fournis. Cela entraîne des retards qui ont un effet sur toutes les autres demandes d'enregistrement dans la file d'attente et contribue à créer un arriéré.
Les étapes de l'examen préliminaire sont actuellement intégrées au procédé d'approbation de l'enregistrement des aliments pour animaux, de sorte que les examinateurs de l'ACIA reçoivent des dossiers de demande complets. Ces étapes supplémentaires dans le procédé peuvent augmenter le délai global pour l'enregistrement d'une demande.
Le procédé simplifié décrit dans le présent document est axé sur l'amélioration de la qualité des demandes d'enregistrement des aliments pour animaux de catégorie 1 afin de réduire le délai total d'examen pour ces produits. Les demandes identifiées comme étant simplifiées ne feront pas l'objet d'un examen technique préliminaire et passeront directement à l'examen technique, conformément aux exigences de simplification.
Avantages
- Les exigences à respecter pour présenter un dossier de demande (complet) de qualité seront plus claires pour l'industrie, ce qui augmentera la probabilité que la demande soit acceptée sans suivi supplémentaire de l'ACIA.
- La priorité sera accordée aux produits répondant aux exigences simplifiées de la catégorie 1.
- Ces produits seront approuvés plus rapidement, car les échanges nécessaires pour clarifier certains points seront réduits et leur examen ne sera pas retardé par les dossiers complexes non clôturés qui les précèdent dans la file d'attente.
- Ce procédé serait plus efficace pour l'industrie et le gouvernement.
Éligibilité du produit
Les produits éligibles au processus simplifié incluent :
- nouveautés et changements importants apportés aux aliments mélangés standard énumérés aux articles 1 à 6 du tableau 3 de l'annexe I du Règlement de 1983 sur les aliments du bétail - aliments complets (aliments d'allaitement compris), suppléments, macro-prémélanges, aliments minéraux, micro-prémélanges, sels enrichis d'oligo-éléments ou aliments modificateurs
- mélanges simples et dilutions d'aliments pour animaux à ingrédient unique ne contenant que des ingrédients figurant à l'annexe IV, partie I, classes 1 à 7.1
Les types de produits suivants ne sont pas admissibles au procédé simplifié :
- produits comportant des garanties à déclaration volontaire supplémentaires ou des allégations sur les étiquettes autres que celles autorisées par les directives réglementaires RG-1 Chapitre 4.12 – Politique sur les allégations permises dans les aliments pour animaux de ferme
- aliments pour animaux médicamenteux importés
- sels minéralisés et aliments minéraux à libre choix pour ruminants avec du sélénium ajouté
- aliments pour visons, renards et poissons autres que le saumon
- les mélanges simples d'aliments pour animaux qui comprennent des produits à base de levure de classe 7.2 de l'annexe IV sont exclus du processus simplifié car ces produits ne sont pas de simples mélanges et sont des suppléments de levure qui sont des aliments de catégorie 2.
Exigences
Le procédé est conçu pour répondre aux exigences du Règlement de 1983 sur les aliments du bétail. Les aliments de catégorie 1 admissibles doivent être étiquetés et comporter les garanties d'éléments nutritifs comprises dans le tableau 3 de l'annexe I. Les garanties relatives aux vitamines et aux minéraux seront comparées aux minimums et aux maximums indiqués dans le tableau 4 de l'annexe I.
Les exigences du processus simplifié ont été organisées en listes de contrôle que vous trouverez ci-dessous :
Des outils ont été développés pour aider l'industrie à démontrer que les exigences ont été respectées et sont disponibles sur le site Web de l'Association de nutrition animale du Canada (ANAC) - Simplification des approbations pour les enregistrements d'aliments pour animaux de catégorie 1
- Outil de vérification et de calcul de la garantie sur l'étiquette
- Garanties en éléments nutritifs requises sur les étiquettes des aliments pour animaux par espèce
- Exemples de trousses d'enregistrement entières pour divers produits
- Prémélange minéral médicamenté pour porcs
- Prémélange minéral pour porcs
- Rations pour vache laitière tarie de 12 % – Aliments complet importés
- Prémélange minéral médicamenté pour vache laitière
- Mélange d'ingrédients – Maïs et tourteau de soja
- Annexes IV et V, version administrative – Liste des ingrédients approuvés des aliments pour animaux
Remarque : les demandeurs doivent s'assurer que leur demande répond aux exigences du processus simplifié. Les demandes qui ne contiennent pas tous les renseignements nécessaires ou qui ne respectent pas les exigences du processus simplifié seront retournés au demandeur, qui devra déposer une nouvelle demande d'enregistrement. Les demandes ne seront pas mises en attente le temps de recevoir des informations supplémentaires ou révisées.
Processus
Le processus d'enregistrement serait le suivant :
- le dossier d'enregistrement est complet et le demandeur a vérifié qu'il respectait bien les exigences.
- il s'agit notamment de vérifier que chaque élément requis (selon la liste de contrôle de l'ACIA) est complet, répond aux exigences réglementaires, est inclus dans le dossier et est présenté dans le même ordre tel que proposé dans la liste de contrôle.
- le demandeur doit :
- envoyer une demande via le service en ligne Mon ACIA
- soumettre le dossier à l'appui de la demande selon le chapitre 1.3
- sélectionner le type d'autorisation dans Mon ACIA : Enregistrement ou approbation
- inscrire dans le nom de la demande en ligne « Demande simplifiée catégorie 1… »
- omettre d'ajouter cette information au nom de la demande pourrait entraîner un processus d'évaluation plus long
- télécharger l'étiquette, la liste de contrôle remplie et signée, les feuilles de calcul et toutes les autres informations requises dans les sections appropriées
- l'ACIA examinera le dossier et :
- délivrera un enregistrement pour les demandes qui sont complètes et qui répondent aux exigences du processus simplifié,
- retournera le dossier si la demande est incomplète.
- la décision d'enregistrement sera ensuite envoyée au demandeur et les frais de demande seront conservés par l'ACIA
Remarque : il s'agit d'une démarche volontaire. Les produits peuvent toujours être soumis à l'enregistrement sans utiliser le processus simplifié, auquel cas les processus et délais d'approbation habituels s'appliqueront. Avant de soumettre leur dossier d'enregistrement à l'ACIA pour évaluation, les membres de l'ANAC peuvent le faire vérifier par l'ANAC – consultez le site Simplification des approbations pour les enregistrements d'aliments pour animaux de catégorie 1 pour en savoir plus.
Exigences et liste de contrôle pour la simplification des approbations des aliments pour animaux de catégorie 1
1. Nouveautés et changements importants apportés aux aliments mélangés standard énumérés aux articles 1 à 6 du tableau 3 de l'annexe I du Règlement de 1983 sur les aliments du bétail –aliments complets (aliments d'allaitement compris), suppléments, macro-prémélanges, aliments minéraux, micro-prémélanges, sels enrichis d'oligo-éléments ou aliments modificateurs
| Exigences | No de page ou S. O. | Utilisation par l'ACIA |
|---|---|---|
|
Dossier de demande dûment rempli est soumis dans le même ordre que sur cette liste de contrôle et conformément au RG-1 Chapitre 1 – Exigences d'administration pour évaluations avant la mise en marché et demandes d'enregistrement pour aliments du bétail
|
||
Étiquette (3 exemplaires) contenant les informations conformément à l'article 26 du Règlement de 1983 sur les aliments du bétail (voir la liste à l'annexe 1) Note: pour les aliments mélangés énumérés aux articles 1 à 6 du tableau 3 de l'annexe I, si des garanties ne figurant pas dans le tableau 3 de l'annexe I sont affichées sur l'étiquette ou si l'étiquette souligne l'inclusion d'un autre aliment mélangé, ces aliments ne sont pas admissibles à l'examen simplifié. Par exemple, des déclarations comme « contient le complexe minéral de Moore » ou « contient la vitamine D de Smith ». Les allégations comprises dans la Politique sur les allégations permises dans les aliments pour animaux de ferme sont autorisées sur l'étiquette si les renseignements à l'appui de l'allégation admissible sont inclus dans la trousse de demande. |
||
| Pour les aliments complets : calculs montrant que les éléments nutritifs nécessitant l'inscription de garanties sur l'étiquette conformément au tableau 3 de l'annexe I atteignent ou dépassent les valeurs minimales du tableau 4 de l'annexe I et ne dépassent pas les valeurs maximales. | ||
Pour les aliments mélangés autres que les aliments complets :
|
||
|
Pour les aliments médicamentés : calculs montrant que le niveau de médicament fourni est conforme au mode d'emploi du Recueil des notices sur les substances médicatrices (RNSM) associé à la l'allégation en question. Remarque : les aliments médicamentés importés ne sont pas éligibles à l'examen simplifié. |
||
Pour les demandes concernant de nouveaux aliments pour animaux et tous les aliments importés :
|
2. Mélanges simples et dilutions d'aliments pour animaux à ingrédient unique ne contenant que des ingrédients figurant à l'annexe IV, partie I, classes 1 à 7.1
Les produits admissibles pour les approbations simplifiées sont les suivants :
- produits destinés à faciliter l'ajout d'ingrédients généralement inclus en petites quantités dans les aliments pour animaux lorsqu'ils sont ajoutés seuls, comme les vitamines et les minéraux.
- mélanges simples d'ingrédients d'aliments pour animaux comme les grains, les céréales et/ou les farines qui fournissent des protéines et de l'énergie (glucides et lipides), c'est-à-dire des macronutriments.
| Exigences | No de page ou S. O. | Utilisation par l'ACIA |
|---|---|---|
|
Dossier de demande dûment rempli est soumis dans le même ordre que cette liste de contrôle et conformément au RG-1 Chapitre 1 – Exigences d'administration pour évaluations avant la mise en marché et demandes d'enregistrement pour aliments du bétail
|
||
Étiquette (3 exemplaires) contenant les information conformément à l'article 26 du règlement (voir la liste à l'annexe 2) Remarque : pour les mélanges simples et les dilutions d'aliments pour animaux à ingrédient unique de l'annexe IV, partie I, classes 1 à 7, seules les garanties indiquées dans les définitions des aliments à ingrédient unique doivent figurer sur l'étiquette.
|
||
Calculs
|
Annexe 1 – Exigences en matière d'étiquetage pour les changements nouveaux et importants apportés aux aliments mélangés standard énumérés aux articles 1 à 6 de l'annexe I, tableau 3, du Règlement de 1983 sur les aliments du bétail
Proposed label
- Marque (facultatif)
- Nom de l'aliment pour animaux/nom du produit tenant compte de l'utilisation prévue du produit et des espèces visées
- Forme de l'aliment pour animaux, si l'aliment contient une substance médicatrice et est sous une forme autre que moulu
- Concentration de la substance médicatrice dans l'aliment et allégation prévue dans le Recueil des notices sur les substances médicatrices (RNSM) (le cas échéant)
- Déclaration à l'égard du sélénium placée immédiatement au-dessus de la déclaration de l'analyse garantie (s'il y a lieu) : « Cet aliment contient
 mg/kg de sélénium »
mg/kg de sélénium » - Analyse garantie : garanties requises conformément au tableau 3 pour le type d'aliment visé
- La liste complète des ingrédients identifiés par nom générique figurant à l'annexe IV ou V du Règlement de 1983 sur les aliments du bétail, y compris les numéros d'enregistrement pour les ingrédients ou les aliments mélangés qui figurent dans la partie II, le cas échéant, ou l'énoncé suivant : « Une liste des ingrédients utilisés dans cet aliment peut être obtenue du fabricant ou du titulaire de l'enregistrement »
- Mode d'emploi afin d'assurer l'innocuité et une utilisation efficace de l'aliment pour animaux
- Mises en garde (dans le cas d'ajout du sélénium) : pour toutes les espèces - « Suivre soigneusement le mode d'emploi ». Pour les ruminants uniquement - « Ne pas utiliser en association avec un autre aliment renfermant du sélénium ajouté »
- Précautions / mises en garde (selon le RNSM, s'il y a lieu)
- Notes (si requises dans le RNSM)
- Déclaration relative à l'Encéphalopathie spongiforme bovine (ESB) si l'aliment renferme des « matières interdites » : « Il est interdit d'en nourrir des bovins, moutons, cerfs ou d'autres ruminants et des amendes ou autres peines sont prévues à cet égard par la Loi sur la santé des animaux. »
- Nom et adresse du titulaire d'enregistrement
- Pour les aliments pour animaux importés : Pays d'origine ou « Importé par ou Importé pour » suivi du nom et de l'adresse de la personne ou de l'entreprise canadienne pour laquelle l'aliment pour animaux a été fabriqué ou produit pour la revente.
- Quantité nette (poids ou volume - mesure métrique requise - autres unités facultatives)
- Numéro d'enregistrement (à ajouter une fois que l'aliment pour animaux est enregistré)
- Numéro de lot (si applicable)
Annexe 2 – Exigences en matière d'étiquetage pour mélanges simples et les dilutions d'aliments pour animaux à ingrédient unique contenant uniquement des ingrédients figurant à l'annexe IV, partie I, classes 1 à 7.1
Étiquette proposée
- Marque (facultatif)
- Nom de de l'aliment pour animaux/nom du produit tenant compte de l'utilisation prévue et des espèces visées
- Analyse garantie : garanties fusionnées conformément aux définitions des ingrédients de l'annexe IV, directement liées aux aliments individuels à ingrédient unique contenus dans le produit
- La liste complète des ingrédients par nom générique figurant à l'annexe IV ou V du Règlement de 1983 sur les aliments du bétail
- Mode d'emploi afin d'assurer l'innocuité et une utilisation efficace de l'aliment pour animaux
- Mises en garde (dans le cas de l'ajout du sélénium) : pour toutes les espèces - « Le mode d'emploi doit être scrupuleusement suivi ». Pour les ruminants uniquement - « Ne pas utiliser en association avec un autre aliment renfermant du sélénium supplémentaire »
- Déclarations d'étiquetage conformément aux définitions des ingrédients de l'annexe IV, directement liées aux aliments individuels à ingrédient unique contenus dans le produit
- Déclaration relative à l'ESB si l'aliment renferme des « matières interdites » : « Il est interdit d'en nourrir des bovins, moutons, cerfs ou d'autres ruminants et des amendes ou autres peines sont prévues à cet égard par la Loi sur la santé des animaux »
- Nom et adresse du titulaire d'enregistrement
- Pour les aliments pour animaux importés : Pays d'origine ou « Importé par ou Importé pour » suivi du nom et de l'adresse de la personne ou de l'entreprise canadienne pour laquelle l'aliment pour animaux a été fabriqué ou produit pour la revente
- Quantité nette (poids ou volume - mesure métrique requise - autres unités facultatives)
- Numéro d'enregistrement (à ajouter une fois l'aliment pour animaux est enregistré)
- Numéro de lot (si applicable)
2.2 Exigences pour l'enregistrement des produits spécialisés
Pour plus d'informations sur l'enregistrement de certains produits d'aliments pour animaux spécialisés, reportez-vous au chapitre 3.
Exigences administratives
1. Les exigences administratives générales par rapport aux demandes d'enregistrement telles qu'indiquées au Chapitre 1 s'appliquent aux produits spécialisés.
2. L'étiquette proposée doit faire état du rôle du produit et être conforme aux normes, et exigences d'emballage et d'étiquetage de la Loi relative aux aliments du bétail et de son règlement. Elle doit comporter les garanties pour les éléments nutritifs ou les ingrédients actifs. Cinq exemplaires de l'étiquette proposée du produit ainsi qu'une copie de la formule de composition du produit (p. ex., en pourcentages) sont exigés pour l'enregistrement.
Description du produit et information pertinente
3. Il faut fournir la liste complète des ingrédients désignés par leur nom générique, tel qu'apparaissant à l'Annexe IV ou V du Règlement sur les aliments du bétail. On doit également inclure les numéros d'enregistrement de tous les ingrédients répertoriés dans la Partie II, des aliments pour animaux de ferme mélangés et d'autres produits enregistrés.
Les aliments pour animaux de ferme mélangés peuvent renfermer des ingrédients qui ne sont pas répertoriés à l'Annexe IV ou V du Règlement sur les aliments du bétail. Si le demandeur compte utiliser un ingrédient qui n'a pas encore été approuvé dans la formule de composition du produit en question, il doit présenter aussi une demande d'enregistrement pour que cet ingrédient soit approuvé dans la composition des aliments pour animaux de ferme au Canada avant de présenter le dossier de demande pour le produit spécialisé dont il est question. Les renseignements concernant le processus de demande relative aux nouveaux ingrédients se trouvent dans la section 2.3, « Exigences pour l'évaluation des ingrédients ». Veuillez prendre note que la demande d'enregistrement pour le produit spécialisé ne sera approuvée que si tous les ingrédients de la formule de composition du produit sont approuvés et énumérés à l'Annexe IV ou V du Règlement sur les aliments du bétail (c'est-à-dire, la soumission sera mise en attente).
4. Il faut également préciser l'usage prévu de l'aliment (en vue de le classer dans une catégorie, par exemple, équilibre cationique et anionique des aliments, aromatisant, antioxydant, additif pour fourrages).
5. Il faut présenter les résultats d'études scientifiques pour étayer chacune des allégations nutritionnelles de chaque étiquette. Ces études doivent satisfaire aux critères suivants :
- elles sont menées par des chercheurs compétents
- elles sont fondées sur les espèces cibles d'animaux de ferme
- elles utilisent des méthodes et des protocoles scientifiques reconnus ou convenables
- elles sont conçues pour faciliter l'analyse statistique (c'est-à-dire, à l'aide d'un modèle statistique convenable, d'un protocole d'échantillonnage approprié et d'un échantillon de taille suffisante)
- les données scientifiques sont analysées à l'aide de méthodes statistiques appropriées
- elles comprennent au moins un groupe de contrôle et un groupe expérimental
- elles montrent une différence significative (P<0,05) entre les groupes de contrôle et expérimentaux
- elles indiquent que le produit, lorsqu'il est utilisé conformément au mode d'emploi, donne lieu a une amélioration importante d'au moins un des aspects liés à la nutrition ou à la production animale visés par l'allégation nutritionnelle
- lorsque le mode d'emploi indique une gamme de taux d'inclusion, le protocole d'étude doit évaluer le taux d'inclusion le plus faible
- elles sont menées dans des conditions (c'est-à-dire, climat, pratiques d'alimentation et de gestion) analogues à celles qu'on peut prévoir au Canada
- si les conclusions de ces études n'ont pas été publiées dans des revues approuvées par des pairs, le Programme des aliments pour animaux exige d'avoir des exemplaires des données brutes et des analyses statistiques.
6. Il faut fournir les certificats d'analyse de trois lots de produits différents et récents et une méthode analytique s'y rattachant pour étayer les garanties qui apparaissent sur l'étiquette du produit.
7. S'il y a lieu, on doit fournir une description des méthodes de contrôle de la qualité pour maintenir l'uniformité du produit.
8. L'agent d'évaluation ou le Laboratoire des aliments pour animaux de ferme peut demander des échantillons du produit (pour des produits comme les additifs pour fourrages, les produits microbiens viables à administration orale pour les animaux de ferme et les suppléments enzymatiques) en vue de vérifier les méthodes analytiques ou les garanties de l'étiquette.
9. S'il y a lieu, on doit fournir les renseignements sur la stabilité (c'est-à-dire, durée de conservation). Il sera nécessaire de présenter des certificats d'analyse étayant la durée de conservation garantie de l'étiquette du produit et sa stabilité (c'est-à-dire, à la date de fabrication et à la date d'expiration) au moins pour trois lots différents du produit. Pour le même lot de produits, il faut fournir les certificats d'analyse pour le niveau ou la concentration des ingrédients actifs à la date de fabrication et à la date d'expiration. Les conditions d'entreposage utilisées dans l'étude de la durée de conservation doivent témoigner des conditions d'entreposage recommandées telles que mentionnées sur l'étiquette du produit.
Renseignements sur l'innocuité
10. Ainsi qu'il est décrit dans les sections 2.3 et 2.4, les études scientifiques étayant l'innocuité du produit peuvent comprendre, entre autres, des analyses chimiques ou de résidus toxiques, des évaluations de la toxicité, des tests nutritionnels, des analyses de résidus dans les tissus. Les études scientifiques présentées pour étayer l'innocuité du produit doivent satisfaire aux critères suivants :
- être menées par des chercheurs compétents
- utiliser des méthodes et des protocoles scientifiques reconnus ou convenables
- être conçues pour faciliter l'analyse statistique (c'est-à-dire, à l'aide d'un modèle statistique convenable, d'un protocole d'échantillonnage approprié et d'un échantillon de taille suffisante)
- être analysées à l'aide des méthodes statistiques appropriées.
11. Il faut également fournir la description des méthodes convenables de détection de concentrations importantes de tout ingrédient, élément nutritif, composé, substance ou organisme incorporé intentionnellement dans l'aliment ou qui s'y trouve comme contaminant.
Exigences pour les modifications importantes concernant l'enregistrement des produits spécialisés
Les demandes de modification importante seront évaluées au cas par cas. On exige les données sur l'innocuité ou l'efficacité (qui satisfont aux critères mentionnés ci-dessus) dans les demandes de modification d'enregistrement pour les changements qui touchent les caractéristiques de produit suivantes, sans toutefois s'y limiter :
- modifications des garanties de l'étiquette pour les éléments nutritifs ou les ingrédients actifs;
- modifications de la formule de composition d'un produit qui augmentent l'efficacité ou la teneur en éléments nutritifs du produit (par exemple, ajout ou suppression d'une culture bactérienne, modifications des ingrédients qui sont la principale source d'éléments nutritifs ou ajout ou suppression d'un agglomérant de granulés);
- modifications du procédé de fabrication qui peuvent modifier la nature du produit ou contribuer à introduire des éléments chimiques (comme contaminants ou additifs) ou modifications des matières de départ, des auxiliaires de fabrication, etc. utilisés dans le procédé de fabrication;
- modifications des allégations de l'étiquette ou ajout d'allégations;
- ajout d'espèces d'animaux de ferme sur l'étiquette du produit (c'est-à-dire, dans les cas où un produit est approuvé seulement pour certaines espèces);
- modifications au mode d'emploi;
- modifications à la durée de conservation du produit.
Veuillez consulter Chapitre 1 pour obtenir des renseignements supplémentaires sur les modifications importantes concernant les produits enregistrés. Les droits à payer pour ces modifications sont les mêmes que pour une nouvelle demande d'enregistrement pour un produit de catégorie 2.
Les modifications de la formule de composition concernant des ingrédients non actifs ou qui ne constituent pas une source importante d'éléments nutritifs (par exemple, arômes, supports) seront évaluées au cas par cas, et peuvent ou non exiger la présentation des données sur l'innocuité ou l'efficacité. Toutefois, il est recommandé de communiquer à l'avance avec le Programme des aliments pour animaux en vue de connaître les renseignements et les documents qui seront exigés avec la demande proposée pour la modification de l'enregistrement.
Critères d'enregistrement pour les produits sous étiquette privée
Le processus d'enregistrement sous étiquette privée a été mis en place afin de permettre aux compagnies de commercialiser un produit déjà enregistré par une autre compagnie sous leur propre nom commercial. On évalue ces demandes pour des aliments courants, pour lesquels aucune évaluation d'efficacité ou d'innocuité n'est nécessaire. Les demandes d'enregistrement d'une étiquette privée doivent aussi inclure une lettre de la compagnie détentrice de l'enregistrement original, signée par une personne autorisée par cette compagnie, autorisant le demandeur à utiliser les renseignements du dossier de la compagnie pour enregistrer ses produits sous étiquette privée.
Comme la formulation du produit sous étiquette privée doit correspondre exactement à la formule de composition approuvée pour le produit original, tout renseignement obligatoire présent sur l'étiquette originale (p. ex. liste des ingrédients, analyse garantie, mode d'emploi, mises en garde) doit l'être sur l'étiquette privée. Si la compagnie détentrice de l'étiquette privée fabrique également l'aliment, la formule de composition et les certificats d'analyse peuvent être demandés.
Les demandes de modification aux enregistrements d'étiquette privée seront évaluées au cas par cas selon les critères suivants :
- Modifications obligatoires
Lorsque la modification de l'enregistrement est obligatoire (c'est-à-dire, les modifications introduites par la Division des aliments pour animaux), la Division informera tous les détenteurs d'un enregistrement pour le type de produit visé par la modification, y compris les détenteurs d'étiquettes privées. Les étiquettes originales et privées doivent être modifiées. Il n'y a pas de frais pour ces modifications.
Dans les cas d'une demande d'étiquette privée pour un produit original dont le statut d'enregistrement ne satisfait pas aux nouvelles exigences obligatoires (en raison de préoccupations liées aux données sur l'innocuité ou l'efficacité), la demande d'étiquette privée sera refusée jusqu'à ce que le produit original satisfasse à toutes les exigences d'enregistrement. Le détenteur d'enregistrement original sera avisé de la situation.
Les modifications obligatoires mineures requises par la Division seront apportées au produit de l'étiquette privée au moment même de l'enregistrement ou du renouvellement de l'enregistrement, même si l'étiquette du produit original n'est pas encore conforme à la nouvelle modification. Dans ce cas, on corrigera l'étiquette privée avant l'étiquette du produit original. Les modifications obligatoires mineures apportées à l'étiquette originale seront apportées au moment du renouvellement ou lorsqu'une demande de modification importante sera présentée à la Division des aliments pour animaux.
- Modifications volontaires
Lorsqu'une modification est approuvée pour le détenteur de l'enregistrement original (par exemple, garantie révisée, ajout d'une allégation, modification de la formule de composition), celui-ci doit en aviser les détenteurs d'étiquette privée. Ces derniers ne sont pas tenus de modifier leur enregistrement en conséquence, pourvu que leurs étiquettes privées soient toujours conformes au Règlement sur les aliments du bétail. Toutefois, si les détenteurs d'étiquette privée choisissent d'indiquer les nouveaux renseignements, ils doivent présenter un dossier de demande de modification importante.
- Renouvellement de l'enregistrement
Pour chaque demande de renouvellement, il faut présenter un exemplaire de la formule de composition du produit (notamment les numéros d'enregistrement pour les ingrédients répertoriés dans la Partie II, les arômes, les aliments pour animaux de ferme mélangés enregistrés, etc.) et une lettre de la compagnie qui détient l'enregistrement du produit original, autorisant le détenteur de l'étiquette privée à continuer d'utiliser les renseignements du dossier de cette compagnie pour renouveler ce produit sous étiquette privée.
À noter : si un produit original est assorti d'un enregistrement temporaire, on accordera également un enregistrement temporaire au produit sous étiquette privée. La date d'expiration sera la même pour les deux produits. Le statut d'enregistrement permanent sera accordé à un produit sous étiquette privée qui avait un statut temporaire seulement si on accorde un statut d'enregistrement permanent au produit original. Si la demande d'enregistrement permanent est présentée au moment du renouvellement, les frais d'enregistrement s'ajouteront aux frais de renouvellement. Si la demande est présentée avant la date d'expiration de l'enregistrement temporaire, les frais d'enregistrement sont les mêmes que ceux d'une nouvelle demande d'enregistrement.
2.3 Exigences pour l'évaluation des ingrédients
L'évaluation d'un ingrédient se fait (sans s'y restreindre) à partir des informations suivantes :
- Si nécessaire, les conditions normales d'enregistrement notamment le pouvoir de signature, l'agent canadien, la demande d'enregistrement dûment remplie et les frais d'enregistrement.
- Étiquetage
Ébauche d'étiquette faisant état du rôle de l'ingrédient et se conformant aux normes et exigences d'emballage et d'étiquetage de la Loi et du Règlement sur les aliments du bétail.
- Description de l'ingrédient
Une description précise de l'ingrédient en vue de préparer une description exacte pour de l'annexe IV ou V (p. ex. 4.2.3 Son de maïs - enveloppe extérieure de grain de maïs, sans la partie amylacée du germe ou avec seulement une très faible quantité de cette dernière).
- Les détails complets de la méthode de fabrication décrivant, si nécessaire, le matériel de départ, les traitements chimiques et/ou physiques et le produit fini (p. ex. 5.3.7. Fin gluten de maïs - résidu séché du maïs après l'extraction du gros de l'amidon et des germes et la séparation du son par les procédés de mouture humide servant à la préparation de l'amidon ou du sirop de maïs, ou par le traitement enzymatique de l'endosperme).
- L'efficacité de l'ingrédient pour l'usage prévu (pour aider à la classification de l'ingrédient aux annexes IV et V).
- Des données documentaires pertinentes provenant d'autres publications (p. ex. les listes de l'Association of American Feed Control Officials, de la National Feed Ingredients Association, du Red Book, du Code of Federal Regulations, du Conseil de l'Europe, etc.).
- Résultats d'enquêtes scientifiques présentés pour étayer les allégations nutritionnelles de l'étiquette devant provenir de recherches : conduites par des chercheurs qualifiés; utilisant des méthodes appropriées; conçues pour faciliter l'analyse statistique; soumises aux analyses statistiques pertinentes; et réalisées dans des conditions semblables à celles qui peuvent exister au Canada.
- Certificat d'analyse permettant d'étayer la garantie, de même que la description des méthodes d'analyse utilisées pour l'ingrédient ou pour un mélange le contenant (p. ex. garantie ou méthode nouvelle).
- S'il y a lieu, une description des méthodes de contrôle de la qualité pour maintenir l'uniformité du produit.
- Description des spécifications du produit, analyses chimiques, concentration en contaminants.
- Échantillon (si nécessaire).
- Renseignements sur l'innocuité (selon le cas)
Les enquêtes scientifiques consistant entre autres, en des analyses chimiques ou de résidus toxiques, des évaluations de la toxicité, des tests nutritionnels, des analyses de résidus dans les tissus, etc., qui sont présentées pour étayer la demande doivent être: conduites par des chercheurs qualifiés; utilisant des méthodes appropriées; conçues pour faciliter l'analyse statistique; soumises aux analyses statistiques pertinentes; et réalisées dans des conditions semblables à celles qui peuvent exister au Canada.
- Des renseignements sur la stabilité du produit, s'il y a lieu.
- Description de méthodes appropriées de détection de concentrations importantes de tout ingrédient, composé, substance ou organisme incorporé intentionnellement ou qui s'y trouve comme contaminant.
2.4 Données générales nécessaire à l'évaluation de l'innocuité des ingrédients
Pour faciliter l'évaluation de l'innocuité des ingrédients et de leur impact sur la santé, en vertu de la section 2.3, voici la liste des données qui seront nécessaires.
Ces exigences s'appliquent tout aliment simple qui n'a pas encore été accepté pour usage au Canada. Les fabricants et détenteurs d'homologation devraient être en mesure de fournir ces renseignements plus spécifiques pourraient être exigés.
Les ingrédients simples déjà approuvés pourraient aussi être sujet à une telle évaluation si un doute sur leur sécurité ou si un usage inapproprié est suspecté.
Ces renseignements sont exigés pour les substances actives, les métabolites importants et tout contaminant d'intérêt.
- Identification et usage du produit
- Nom
- Autres noms (p. ex., nom international, nom chimique, nom botanique, etc.)
- Taux, rythme, intervalles de l'alimentation, et période de retraite suggérés
- Identification des espèces visées
- Quantité unitaire
- Étiquette du produit et fiches signalétiques du produit ou des ingrédients
- Description du procédé de fabrication
- Constituants chimiques et impuretés
- Nom chimique et synonymes
- Formule chimique (moléculaire st structurale)
- Numéro du « Chemical Abstract Service » (CAS)
- Concentration dans le produit fini (% du ppm)
- Critères d'identification chimique et du pureté
- Durée estimée de conservation
- Méthode(s) d'analyse, limite(s) de récupération et de détection des analyses (voir section 6.2)
- Données physico-chimiques (s'il y a lieu)
- Masse moléculaire
- État Physique
- Apparence (p. ex. granuleux, gélatineux)
- Grosseur des particules
- Couleur et odeur
- Limite de détection olfactive
- Densité/masse spécifique
- Index de réfraction
- Point de fusion
- Point d'ébullition
- Point d'éclair
- Température d'allumage spontané
- Pression de vapeur
- Densité de vapeur
- pH
- Solubilité dans l'eau
- Coefficient de partage octanol-eau
- Solubilité dans d'autres solvants
- Incompatibilité
- Polymérisation
- Donnés toxicologiques pour le bétail
- Études du métabolisme et des résidus pour le bétail
- Étude du métabolisme, y compris les méthodes analytiques avec limites de récupération et de détection
- Études des résidus du composé mère et de ses métabolites possible, y compris les méthodes analytiques avec limites de récupération et de détection
- Données sur l'excrétion
- Limite maximale de résidu(s) ou tolérance suggérée
- Toxicité pour les mammifères
Les données minimales requises pour les mammifères sont soulignées. Pour certains produits ou constituants, les données additionnelles pourraient être exigées.
- Voies d'entrée
- Taux et degré d'absorption
- Données sur la distribution, le métabolisme et l'excrétion
- Estimation de l'exposition
- Toxicité aiguë : DL50, irritation cutanée/oculaire, sensibilisation de la peau, mutagénicité (avec et sans activation)
- Toxicité à court terme (p. ex., étude de 28 jours)
- Teratogénicité
- Cancérogénicité
- Effets sur le développement
- Effets sur la reproduction
- Études épidémiologiques
- Interactions chimiques
- Devenir et effets dans l'environnement
- Pression de vapeur et volatilisation
- Hydrolyse
- Photodégradation
- Solubilité dans l'eau
- Coefficient de partage octanol-eau
- Adsorption-désorption
- Lessivage
- Biotransformation dans le sol (aérobique/anaérobique)
- Biotransformation dans les systèmes aquatiques (aérobique/anaérobique)
- Toxicologie de la faune
- Toxicologie des organismes aquatiques
- Toxicologie des organismes du sol
À noter : Si les évaluation révélaient la présence de résidus dans les tissus en quantité supérieure aux normes admises, la Direction des aliments de Santé Canada pourrait exiger des données plus élaborées avant l'approbation du produit.
2.5 Exigences en matière de données pour l'évaluation de la sécurité des produits : notes explicatives
Cette section explique les exigences relatives aux données pour l'évaluation de la sécurité des aliments du bétail. Elle doit être utilisée en conjonction avec la Section 2.3 « Exigences pour l'évaluation des ingrédients » et la Section 2.4 « Données générales nécessaires à l'évaluation de l'innocuité des ingrédients simples » du document des Directives réglementaires RG-1.
Nous avons tenté de rendre ce guide utile pour ceux qui souhaitent avoir une connaissance générale des données requises, et pour aider avec l'élaboration d'une présentation de données plus complètes. Nous citons les protocoles normalisés utilisés pour calculer chaque type de donnée et présentons dans la bibliographie une liste complète de ces protocoles et des autres sources consultées.
Les questions devraient être adressées à la :
Division des aliments pour animaux
Agence canadienne d'inspection des aliments
59, Promenade Camelot
Ottawa ON K1A 0Y9
Télécopieur : 613-773-7565 ou 613-773-7566
1.0 Identification et utilisation du produit
Pour chaque ingrédient ou produit, veuillez identifier les renseignements suivants :
A) Nom et synonymes
Nom du produit tel qu'il apparaît sur son étiquette ou sur son connaissement. Autres noms ou acronymes communément utilisés, incluant les noms utilisés dans d'autres pays, la plupart des noms chimiques communs, l'identification d'espèces botaniques ou animales, etc.
B) Description de l'utilisation
Décrire l'utilisation prévue du produit dans les aliments du bétail. Les types de renseignements exigés comprennent les suivants :
- une description détaillée de l'utilisation prévue du produit
- le taux d'utilisation suggéré et maximal, le rythme et la fréquence d'alimentation, et les méthodes d'application
- renseignements sur le mélange, si le produit est utilisé en conjonction avec d'autres produits
- « délais d'attente » (c.-à-d., lorsque l'utilisation du produit doit être réduite ou interrompue)
- renseignements relatifs à la distribution, à l'entreposage et à la manutention, y compris les mesures d'urgence recommandées
- stratégies relatives à la réutilisation, à la revente ou à la mise au rebut du produit inutilisé.
C) Espèces auxquelles est destiné le produit
Nommer tous les types de bétail auxquels le produit est destiné.
D) Quantités
Identifier les quantités de produit qu'on prévoit vendre, transporter et entreposager (p. ex., fût métallique de 50 L ou sac de toile à revêtement intérieur de plastique de 20 kg).
E) Étiquette du produit
Fournir cinq copies de l'étiquette du produit ou du connaissement. On peut trouver les directives pour les exigences concernant l'étiquetage dans la Section 4.1 du document Directives réglementaires RG-1.
F) Fiche signalétique (FS) du produit et de ses ingrédients
Une fiche signalétique est un bulletin technique exhaustif contenant des renseignements détaillés sur une substance ou un produit. Il s'agit d'une source de renseignements fondamentale pour les évaluations préliminaires en matière de sécurité qui souligne les points susceptibles de nécessiter un examen plus approfondi. Le Système d'information sur les matières dangereuses utilisées au travail (SIMDUT) spécifie les critères applicables pour l'élaboration d'une FS. Veuillez consulter la Section 8.1 du document Directives réglementaires RG-1, « Responsabilités concernant l'étiquetage des aliments du bétail selon le Système d'information sur les matières dangereuses utilisées au travail (SIMDUT) ».
G) Description du procédé de fabrication
Veuillez fournir une description détaillée des procédés de production et de formulation, répertoriant toutes les matières premières, les durées et les températures du traitement, les traitements chimiques et physiques y compris les étapes de transformation additionnelles, et tout autre paramètre susceptible d'influencer les spécifications, la qualité ou la sécurité d'un produit.
Il est conseillé de joindre un ordinogramme à la description.
2.0 Constituants chimiques, incluant les contaminants et les impuretés
A) Nom et synonymes
Doivent figurer dans la liste les noms chimiques et synonymes de tous les ingrédients.
Ressources
- CEPA "Guidelines for the Notification and Testing of New Substances: Chemicals and Polymers" (Appendix 5) (anglais seulement)
- Chemical Abstracts Services (CAS) Registry (anglais seulement)
- International Union of Pure and Applied Chemistry (IUPAC) (anglais seulement)
- Combined Chemical Dictionary (anglais seulement)
B) Contaminants et impuretés
Des contaminants et impuretés inhérents au produit ou introduit durant la transformation doivent être identifiés et caractérisés.
C) Numéro du Chemical Abstracts Service Registry
Un numéro d'identification est attribué par le Chemical Abstracts Service (CAS) à chaque substance chimique connue afin de la différencier des autres. Ce numéro constitue une référence utile lorsque l'on recherche des informations techniques et doit être indiqué pour chaque ingrédient.
Ressources
D) Formule chimique (moléculaire et développée)
La formule moléculaire identifie les éléments fondamentaux (atomes) des molécules. La formule développée est un schéma des liaisons existant entre les atomes. La comparaison de ces formules avec celles de substances dont les propriétés sont connues est utile pour prévoir les dangers des composés qui n'ont pas fait l'objet d'essais. Lorsqu'il existe des mélanges isomériques, il faut inclure le ratio des isomères, car les différents isomères peuvent avoir des toxicités différentes. En ce qui concerne les polymères (longues chaînes de molécules), les formules développées doivent montrer les unités récurrentes, tout en montrant les liaisons intramoléculaires et les réticulations.
Ressources
- ChemBioFinder.com (anglais seulement)
- LCPE « Directives pour la déclaration et les essais de substances nouvelles : substances chimiques et polymères » (Appendice 5) (anglais seulement)
E) Concentration des composants
La quantité de tous les ingrédients et contaminants et de toutes les impuretés doit être exprimée sous forme de pourcentage en poids du produit final, ou en parties par millions (ppm).
F) Critères d'identification et de pureté
La formulation exacte d'un produit donné peut varier d'un fabricant à l'autre. Il est nécessaire de disposer d'une description précise des ingrédients, incluant les propriétés physiques et chimiques et les contaminants ou impuretés, afin d'évaluer adéquatement la sécurité du produit. Les méthodes pour mesurer les ingrédients ou les contaminants dans le produit doivent être énoncées. Parmi les méthodes analytiques acceptables pour détecter les composants, mentionnons l'analyse immédiate, la résonance magnétique nucléaire, la spectrographie de masse et la chromatographie, etc.
Veuillez consulter la Section 6.2 du document des Directives réglementaire RG-1 pour les renseignements exigés concernant les méthodes analytiques appliqués par le requérant ou titulaire de l'homologation.
Ressources
G) Durée limite d'entreposage prévue
Il s'agit de la période pendant laquelle le produit peut être entreposé sans atteinte significative à sa constitution chimique et biologique. Ceci comprend les durées de vie de stockage sous des conditions idéales, une description des facteurs influant sur la durée limite d'entreposage, ce qui se passe lorsque le produit est soumis à la dégradation ou la transformation, comment savoir si la dégradation a eu lieu, les dangers associés au dépassement de la durée limite d'entreposage, et sur la base de quels essais le fabricant a estimé ces paramètres.
La durée limite d'entreposage peut être déterminée selon les normes de l'industrie, une évaluation de la qualité et une évaluation de la constitution.
Ressources
- Manitoba Agriculture, Food and Rural Initiatives, Shelf-life Studies (anglais seulement) - (Agriculture, Alimentation et Initiatives rurales Manitoba)
3.0 Méthode(s) d'analyse, récupération et données relatives aux limites de détection des analyses
Des méthodes d'analyse acceptables sont exigées pour établir la pureté des ingrédients (y compris la présence des contaminants), et pour la capacité de détecter l'ingrédient dans les aliments du bétail au taux d'utilisation prévue. Ces méthodes doivent établir des données statistiquement pertinentes en ce qui concerne la récupération et les limites de détection et doivent permettre à des laboratoires tiers d'identifier et de quantifier les ingrédients actifs. Pour ce qui est des exigences particulières et méthodes analytiques, veuillez consulter la Section 6.2 du document des Directives réglementaires RG-1.
Autres Ressources
4.0 Données physico-chimiques
Les données physico-chimiques sont utilisées pour identifier les substances ou les produits, les différencier, ainsi que pour aider à prévoir ou à déterminer le comportement des substances dans le corps humain, dans des organismes visés et non-visés, et dans l'environnement. Veuillez noter les protocoles de référence associés à chaque type de donnée.
A) Masse moléculaire
Tout produit chimique possède une « masse moléculaire caractéristique ». Dans le cas des polymères (des chaînes de molécules longues et récurrents), on donne une valeur moyenne.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
B) État physique
Indique si une substance ou un produit est solide, liquide ou gazeux à la température de la pièce.
C) Aspect
Décrit la forme physique du produit. Exemples : solide granulaire, liquide gélatineux, ou poudre fine.
D) Dimension des particules
Si la substance est solide veuillez décrire la dimension moyenne de ces particules. Veuillez fournir l'étendue des dimensions des particules et leur proportion de distribution. Cette propriété peut être un facteur significatif pour déterminer la distribution physique et l'absorption biologique d'une substance.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
ASTM International
E) Couleur et odeur
Inclure cette description pour chaque ingrédient ainsi que pour le produit formulé.
F) Limite de détection olfactive
Concentration minimale (p. ex., parties par million par volume dans l'air) à laquelle il est possible de reconnaître une substance à son odeur. Cette limite est importante pour déterminer si l'odeur d'une substance peut ou non servir d'avertissement valable de sa présence.
G) Masse volumique ou densité
La densité des solides est mesuré en masse par volume (c.-à-d. g/mL). Pour les liquides, la densité compare leur masse volumique à celle de l'eau, à laquelle on a attribué la valeur 1 (c.-à-d., une substance ayant une densité de 2,0 est deux fois plus dense que l'eau). La masse volumique n'a pas d'unités et est mesurée aux températures de
15,6 °C, 20 °C et 25 °C. Ces mesures sont utiles à de nombreux égards, en particuliers lorsqu'il faut prévoir le comportement d'une substance dans l'environnement, et la comptabilisation des concentrations d'emploi dans les aliments du bétail.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
H) Indice de réfraction
Lorsque la lumière passe d'un milieu à l'autre, la vitesse de la lumière change. Changer la vitesse de la lumière peut provoquer une « déviation » des rayons lumineux. L'indice de réfraction varie d'une substance à l'autre et est parfois utile pour identifier les substances par une technique simple et précise.
Ressources
I) Point de fusion
Il s'agit de la température (à une pression donnée, 101,325 kPa : 1 atm) à laquelle un solide devient un liquide. Dans les cas où la substance subit une réaction chimique (p. ex., dégradation, décomposition, réarrangement) autre que la fusion, la température à laquelle se produit la réaction doit alors être déclarée. Autrement, un point d'écoulement, un point de ramollissement, ou un point de sublimation peut être fourni lorsqu'approprié.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
J) Point d'ébullition
Il s'agit de la température (à une pression donnée, 101,325 kPa : 1 atm) à laquelle un liquide devient gazeux. Dans les cas où la substance subit une réaction chimique (p. ex. dégradation, décomposition, réarrangement) autre que l'ébullition, la température à laquelle la réaction se produit doit être déclarée.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
K) Point d'éclair
Le point d'éclair est la température minimale à laquelle un liquide peut s'enflammer au contact d'une flamme ou d'une étincelle en présence d'oxygène. Le point d'éclair a des conséquences évidentes pour la sécurité des travailleurs durant la manutention et l'entreposage.
Ressources
- ISO 2592:2000 – Détermination des points d'éclair et de feu – Méthode Cleveland à vase ouvert
- ISO 1523:2002 – Détermination du point d'éclair – Méthode à l'équilibre en vase clos
L) Point d'auto-inflammation
Le point d'auto-inflammation est la température minimale à laquelle un liquide inflammable s'enflamme spontanément en l'absence de source d'inflammation.
Ressources
M) Pression de vapeur
Il s'agit d'une mesure de la capacité d'un liquide de s'évaporer ou de libérer des vapeurs à une température donnée. D'ordinaire, elle s'exprime en millimètres de mercure (mm Hg); il s'agit en outre d'un indicateur essentiel du comportement d'un produit liquide, qui indique notamment si le produit aura tendance à se libérer dans l'atmosphère ou à rester dans le sol.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
N) Densité de vapeur
La densité de vapeur est le rapport entre la masse d'un gaz et celle de l'air sec (auquel on attribue la valeur 1). Par exemple, une substance ayant une densité de vapeur de 2,0 est deux fois plus dense que l'air. Les gaz moins denses ont tendance à s'élever et sont rapidement transportés dans l'environnement; les gaz plus lourds demeurent plus près du sol et se dissipent moins rapidement.
O) Constante de la loi d'Henry
Il s'agit d'une mesure de la solubilité d'un gaz dans les liquides. Ce paramètre indique la tendance d'une substance à se déplacer de l'eau vers l'air, ou vice-versa.
Ressources
P) Potentiel hydrogène (pH)
Cette propriété indique si une substance est acide, neutre ou basique et quantifie la force d'acidité ou d'alkalinité. Le pH d'une substance peut avoir un effet majeur sur ses interactions avec les organismes vivants, par exemple le degré auquel celle-ci est absorbée ou ingérée.
Ressources
Q) Solubilité
i) L'eau
La solubilité décrit la quantité d'une substance qui se dissoudra dans l'eau à une température donnée. Puisque beaucoup de substances chimiques se dissolvent dans l'eau à un degré significatif, il s'agit souvent de la voie par laquelle les substances chimiques sont absorbées par les organismes. Ce paramètre est également utilisé pour prévoir le devenir des substances dans l'environnement.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
ii) Autres solvants
La solubilité décrit la quantité d'une substance qui se dissoudra dans des solvants autres que l'eau. Cette mesure de la solubilité sert de guide dans le choix d'un solvant pour extraire une substance des matrices complexes (c.-à-d., un tissu ou un sol).
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
R) Coefficient de partage octanol/eau
Ce paramètre mesure la tendance d'une substance à se séparer dans des solvants organiques ou dans l'eau. Il est utilisé pour prédire si une substance est susceptible de s'accumuler dans les tissus adipeux d'un organisme, ainsi que pour évaluer sa tendance à adhérer aux particules du sol.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 107 : Coefficient de partage (n-octanol/eau) – méthode par agitation en flacon
- Essai No 117 : Coefficient de partage (n-octanol/eau) – méthode chromatographie liquide à haute performance (CLHP)
- Essai No 123 : Coefficient de partage (1-octanol/eau) – méthode du brassage lent
S) Constante de dissociation
La dissociation est un type particulier de décomposition chimique par lequel une molécule se décompose en particules chargées appelées ions. Les ions participent souvent eux-mêmes à d'autres réactions chimiques ultérieures et peuvent être absorbés ou distribués à un taux différent. Dans des conditions données, le taux de dissociation (la constante de dissociation, ou Kd) est constant.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
T) Incompatibilité
Certaines substances réagissent avec d'autres substances. Si le produit formulé, ou l'un ou l'autre de ses ingrédients, entre en contact avec d'autres substances, il convient de le préciser.
U) Polymérisation
Dans certaines conditions, certaines substances peuvent spontanément se polymériser (former de longues chaînes moléculaires). Bon nombre de ces réactions peuvent produire des quantités de chaleur dangereuses ou explosives. Toute substance de cette catégorie contenue dans le produit formulé doit être mentionnée, ainsi qu'une description des conditions dans lesquelles on sait qu'une polymérisation spontanée se produit.
5.0 Données toxicologiques chez les mammifères
Pour évaluer les effets néfastes possibles d'une substance chez les mammifères, il est nécessaire de disposer de données fournies par des essais en laboratoire. Les doses doivent être administrées aux animaux expérimentaux en utilisant la ou les mêmes voies devant être la ou les plus importantes voies d'exposition chez le bétail et possiblement chez les humains (p. ex., par voie orale ou cutanée, ou encore par inhalation). Veuillez noter que les voies d'exposition à une substance pour l'ensemble de la population humaine et celles pour les ouvriers dans un milieu de travail peuvent varier.
Les types de données sur la toxicité généralement considérés sont décrits ci-dessous.
A) Études toxicocinétiques (absorption, distribution, métabolisme et élimination)
Pour chaque voie susceptible d'être empruntée par une substance pour pénétrer dans l'organisme (par voie cutanée, orale, respiratoire, etc.), les essais d'absorption déterminent dans quelle mesure et à quelle vitesse elle peut être absorbée.
Les données relatives à la distribution, au métabolisme et à l'élimination décrivent le devenir d'une substance, une fois absorbée dans l'organisme. Les questions auxquelles ces renseignements peuvent répondre comprennent : Quel est le sort métabolique de la substance? S'accumule-t-elle? Est-elle décomposée ou transformée? Quels métabolites sont produits? Par quelle voie et à quelle vitesse les substances sont-elles éliminées? Ces renseignements fournissent une indication de la capacité d'un organisme de tolérer une exposition à court ou à long terme, et à une concentration élevée ou faible de produit. Il permet aussi de concevoir des essais de toxicité (p. ex., le choix des doses), et l'extrapolation des données des modèles animaux appliqués à l'exposition chez les humains.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
B) Études sur la toxicité aiguë
Les essais d'exposition aiguë examinent les effets d'une exposition unique à des concentrations élevées d'une substance. Dans ces essais, l'exposition dure en général 24 heures ou moins et ses effets sont surveillés d'au plus deux semaines. Il s'agit de la première étape dans l'établissement de la relation cruciale entre la dose et l'effet, pour classer les substances par ordre de toxicité aiguë relative, à des fins de classification, ainsi que pour les mises en garde sur l'étiquette. Les données sur la toxicité aiguë sont utilisées pour obtenir des informations préliminaires sur les effets toxiques particuliers des substances, ainsi que sur les modalités d'apparition de ces effets toxiques (mode d'action). Certains essais d'exposition aiguë spécialisés sont décrits ci-dessous.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 402 : Toxicité cutanée aiguë
- Essai No 403 : Toxicité aiguë par inhalation
- Essai No 420 : Toxicité aiguë orale – Méthode de la dose prédéterminée
- Essai No 423 : Toxicité aiguë par voie orale – Méthode par classe de toxicité aiguë
- Essai No 425 : Toxicité aiguë par voie orale – Méthode de l'ajustement des doses
- Essai No 436 : Toxicité aiguë par inhalation – Méthode par classe de toxicité
United States Code of Federal Regulations
- United States Code of Federal Regulations (anglais seulement)
Dermal Toxicity (40CFR798.2250)
Inhalation Toxicity (40CFR798.2450)
Oral Toxicity (40CFR798.2650)
i) Études sur la dose létale moyenne (aiguë)
Concentration d'une substance qui, lorsqu'elle est administrée une fois à un groupe d'animaux pendant une brève période, cause la mort de la moitié des animaux. Elle est exprimée sous forme de DL50 (dose létale, en mg/kg de poids corporel), ou de CL50 (concentration létale, en parties par million).
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
ii) Études sur l'irritation cutanée ou oculaire
Détermine si une substance a le potentiel de causer une irritation ou la mort cellulaire (nécrose) au contact de la peau ou des yeux.
Des nouvelles méthodes doivent être évaluées par l'ACIA pour déterminer si elles fournissent suffisamment d'information. Nous vous conseillons donc de contacter la Division des aliments pour animaux concernant la validité des méthodes utilisées comme solutions possibles à l'expérimentation sur les animaux.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 404 : Effet irritant/corrosif aigu sur la peau
- Essai No 405 : Effet irritant/corrosif aigu sur les yeux
- Essai No 427 : Absorption cutanée : méthode in vivo
- Essai No 428 : Absorption cutanée : méthode in vitro
- Essai No 430 : Corrosion cutanée in vitro : Essai de résistance électrique transcutanée (RET)
- Essai No 431 : Corrosion cutanée in vitro : Essai sur modèle de peau humaine
- Essai No 435 : Méthode d'essai in vitro sur membrane d'étanchéité pour la corrosion cutanée
- Essai No 437 : Méthode d'essai d'opacité et de perméabilité de la cornée bovine pour l'identification de substances corrosives et fortement irritantes pour l'œil
- Essai No 438 : Méthode d'essai sur œil de poulet isolé pour l'identification de substances corrosives et fortement irritantes pour les yeux
- Essai No 439 : Irritation cutanée in vitro : Essai sur épiderme humain reconstitué
United States Code of Federal Regulations
iii) Études sur la sensibilisation cutanée
Ceci consiste à évaluer le potentiel d'une substance de rendre « plus sensible » les organismes. Après une exposition initiale, les organismes peuvent devenir plus sensibles à cette substance et des réactions allergiques peuvent se manifester lors des expositions ultérieures.
Les tests épicutanés effectués correctement (que la réaction soit positive ou négative) peuvent être une solution possible acceptable à l'expérimentation sur les animaux. La concentration d'une substance pour les sujets exposés constituera un facteur critique quant à l'évaluation de l'acceptabilité des tests épicutanés. De plus, l'information pour l'évaluation de l'irritation cutanée ou oculaire peut être obtenue à partir des relations quantitatives structure-activité (QSAR), avec une justification scientifique suffisante fournie par le demandeur concernant le domaine de validitation et l'applicabilité du modèle.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 406 : Sensibilisation de la peau
- Essai No 429 : Sensibilisation cutanée : Essai de stimulation locale des ganglions lymphatiques
- Essai No 442A : Sensibilisation cutanée: Essai de stimulation locale des ganglions lymphatiques : DA
- Essai No 442B : Sensibilisation cutanée: Essai de stimulation locale des ganglions lymphatiques : BrdU -ELISA
United States Code of Federal Regulations
C) Études sur la mutagénicité ou la génotoxicité
Des mutations de l'ADN peuvent mener à l'apparition d'un cancer ou d'une malformation causé par les gènes chez la progéniture. Des essais de dépistage sont utilisés pour déterminer le potentiel d'une substance d'engendrer des mutations génétiques. Au moins deux types d'essais sont effectués en général, l'un sur des cultures bactériennes et l'autre sur des cultures de cellules mammaliennes. Il est également nécessaire d'effectuer les essais avec et sans activation métabolique, c'est-à-dire de déterminer si les interactions avec les processus métaboliques dans l'organisme produirait une substance mutagène.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 471 : Essai de mutation réverse sur des bactéries
- Essai No 473 : Essai d'aberration chromosomique in vitro chez les mammifères
- Essai No 474 : Le test de micronoyaux sur les érythrocytes de mammifères
- Essai No 475 : Essai d'aberration chromosomique sur moelle osseuse de mammifères
- Essai No 476 : Essai in vitro de mutation génique sur des cellules de mammifères
- Essai No 477 : Toxicologie génétique : Essai de mutation létale récessive liée au sexe chez Drosophilia melanogaster
- Essai No 478 : Toxicologie génétique : Essai de mutation létale dominante chez le rongeur
- Essai No 479 : Toxicologie génétique : Essai in vitro d'échange de chromatides-soeurs sur cellules de mammifère
- Essai No 480 : Toxicologie génétique : Saccharomyces cerevisiae, essai de mutation génique
- Essai No 481 : Toxicologie génétique : Saccharomyces cerevisiae, essai de recombinaison mitotique
- Essai No 482 : Toxicologie génétique : Lésion et réparation d'ADN - Synthèse non programmée de l'ADN (UDS) sur cellules de mammifère – in vitro
- Essai No 483 : Toxicologie génétique : Essai cytogénétique sur cellules germinales de mammifère
- Essai No 484 : Toxicologie génétique : Spot test chez la souris
- Essai No 485 : Toxicologie génétique : Essai de translocation héréditaire chez la souris
- Essai No 486 : Essai de synthèse non programmée de l'ADN (UDS) sur des hépatocytes de mammifères in vivo
- Essai No 487 : Essai in vitro de micronoyaux sur cellules de mammifères
Santé Canada
United States Code of Federal Regulations
D) Études sur la de toxicité à court terme
Les études de toxicité à court terme consistent en une exposition répétée à une substance durant une période plus longue (c.-à-d. 14 à 90 jours). Elles sont utiles pour détecter des effets nocifs pour la santé long terme, pour établir la dose sans effet observé, pour déterminer les effets cumulatifs possibles de l'exposition, de variation de l'espèce, ainsi que pour déterminer les conditions appropriées pour les essais chroniques, s'il y a lieu. On procède en général à une étude de 90 jours par voie orale, et les études par inhalation ou par voie cutanée sont parfois appropriées, selon l'exposition typique chez l'humain.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 407 : Toxicité orale à doses répétées - pendant 28 jours sur les rongeurs
- Essai No 408 : Toxicité orale à doses répétées - rongeurs : 90 jours
- Essai No 409 : Toxicité orale à doses répétées - non-rongeurs : 90 jours
- Essai No 410 : Toxicité cutanée à doses répétées: 21/28 jours
- Essai No 411 : Toxicité cutanée subchronique : 90 jours
- Essai No 412 : Toxicité subaigüe par inhalation : étude sur 28 jours
- Essai No 413 : Toxicité subchronique par inhalation : 90 jours
- Essai No 419 : Neurotoxicité différée de substances organophosphorées: Étude à dose répétée sur 28 jours
E) Études sur la toxicité chronique
En divers cas, des études sur la toxicité chronique peuvent être nécessaires pour évaluer la sécurité d'une substance sur une période plus longue, comme la durée de vie de l'animal (p. ex., 120 jours jusqu'à 2 ans). Ces études sont utiles pour détecter les effets nocifs subtils, comme la carcinogenèse et les effets sur la reproduction. Quelques études sur la toxicité chronique sont décrites dans les sections suivantes.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 452 : Études de toxicité chronique
- Essai No 453 : Études combinées de toxicité chronique et de cancérogenèse
F) Études sur la tératogénicité et la toxicité développementale
Les études sur la tératogénicité examinent les effets nocifs induits durant le développement, de la conception jusqu'à la naissance.
Les essais sur la toxicité développementale examinent les effets nocifs durant la vie d'un organisme avant la conception, durant le développement prénatal ou jusqu'à la maturité sexuelle, découlant de l'exposition de l'un ou l'autre des parents à une substance.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 414 : Étude de la toxicité pour le développement prénatal
- Essai No 421 : Essai de dépistage de la toxicité pour la reproduction et le développement
- Essai No 422 : Étude combinée de toxicité à doses répétées et de dépistage de la toxicité pour la reproduction et le développement
United States Code of Federal Regulations
- United States Code of Federal Regulations (anglais seulement)
Inhalation Developmental Toxicity Study (40CFR798.4350)
Developmental Toxicity Study (40CFR798.4900)
G) Toxicité pour la reproduction
Ces études examinent les effets nocifs des substances sur l'appareil reproducteur mâle ou femelle ainsi que sur leur capacité de reproduction (de l'accouplement à la lactation). D'ordinaire, elles constituent des études portant sur plusieurs générations.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 414 : Étude de la toxicité pour le développement prénatal
- Essai No 415 : Étude de toxicité pour la reproduction sur une génération
- Essai No 416 : Étude de toxicité pour la reproduction sur deux générations
United States Code of Federal Regulations
H) Neurotoxicité
Ces études examinent les effets nocifs des substances sur le système nerveux (le système nerveux central et le système nerveux périphérique).
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 418 : Neurotoxicité différée de substances organophosphorées à la suite d'une exposition aiguë
- Essai No 419 : Neurotoxicité différée de substances organophosphorées : Étude à dose répétée sur 28 jours
- Essai No 424 : Étude de neurotoxicité
- Essai No 426 : Étude de neurotoxicité pour le développement
I) Cancérogénicité
Lorsque d'autres données ou des essais antérieurs l'indiquent, on examine la capacité d'une substance d'induire le cancer (tumeurs) chez les animaux. En général, les essais sont menés sur une longue période de la durée de vie de l'animal, et sont souvent combinés à des essais de toxicité chronique.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 451 : Études de cancérogenèse
- Essai No 453 : Études combinées de toxicité chronique et de cancérogenèse
United States Code of Federal Regulations
- United States Code of Federal Regulations (anglais seulement)
Oncogenicity (40CFR798.3300)
Combined Chronic Toxicity/Oncogenicity (40CFR798.3320)
J) Études sur la œstrogénicité
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 440 : Bio-essai utérotrophique chez les rongeurs: Essai de dépistage à court terme des propriétés œstrogéniques
- Essai No 441 : Bio-essai de Hershberger sur le rat : Essai de dépistage à court terme de propriétés (anti)androgéniques
- Essai No 455 : Essai d'activation transcriptionnelle faisant intervenir le récepteur d'œstrogène alpha humain transfecté de façon stable pour la détection de l'activité œstrogénique agoniste des substances testées
K) Études épidémiologiques
Dans ce type d'étude, on compile et on analyse les informations sur les humains qui ont été exposés à une substance, soit par leur travail, soit par accident.
6.0 Limite maximale de résidus (LMR) ou tolérance suggérée
Une limite maximale de résidus (LMR) régit la concentration d'une substance chimique susceptible de s'accumuler dans les tissus des plantes ou du bétail sans avoir d'effet nocif chez la plante ou l'animal en question, ou chez l'humain qui consomme leurs produits. Cette limite doit être fondée sur une évaluation des informations telles que données sur la toxicité chez les mammifères, estimations de l'apport alimentaire et données sur le métabolisme du bétail.
7.0 Données sur l'exposition humaine et estimation de l'exposition
Les informations qui suivent sont importantes pour évaluer le degré d'exposition des travailleurs et des utilisateurs à une substance donnée.
A) Principales voies d'exposition
L'exposition humaine à une substance dépend en partie de la voie empruntée par celle-ci pour pénétrer dans l'organisme (c.-à-d., par la voie respiratoire, de l'absorption cutanée, de l'ingestion orale, etc.) Selon les propriétés des ingrédients d'un produit, sa formulation et ses méthodes d'utilisation, veuillez décrire comment les utilisateurs pourraient être exposés.
B) Quantité de produit manipulé par les travailleurs et les consommateurs
Veuillez fournir la quantité totale de produit qui serait généralement utilisée par les travailleurs à la journée (p. ex., 50 litres/jour).
C) Fréquence et durée de l'exposition
Indiquez combien de temps et à quelle fréquence ce produit sera normalement utilisé. Dénotez la durée de l'exposition pour chaque période d'utilisation.
D) Concentration du produit lors de l'exposition
Indiquez la concentration du produit lorsqu'il est transporté, entreposé et utilisé. Veuillez décrire toutes les étapes intermédiaires de préparation, notamment le mélange et la dilution.
E) Études sur l'exposition
Inclure toutes les données sur l'exposition humaine, l'absorption dans l'organisme et les études médicales portant sur les travailleurs qui ont été exposés au produit pendant une longue période. Dans certains cas, les études sur l'exposition peuvent être utiles pour établir le degré d'absorption et la distribution de la substance dans les conditions prévues d'utilisation.
8.0 Études sur les résidus et le devenir métabolique chez le bétail
Les données sur la toxicité chez les mammifères obtenues par des essais sur la souris et le rat fournissent des indications limitées du risque d'une substance particulière pour le bétail. Les exigences suivantes en matière de données font intervenir des essais directs sur le bétail.
Ressources
- Organisation mondiale de la Santé
Guidelines for the Study of Dietary Intakes of Chemical Contaminants (anglais seulement)
A) Études toxicocinétiques dans les espèces du bétail
Ces essais décrivent exactement les étapes par lesquelles passe une substance, une fois ingérée par le bétail. Les objectifs consistent à établir la vitesse et le mode d'absorption dans la grande circulation, la distribution dans le corps, la vitesse de métabolisme, des voies métaboliques possibles et tous les métabolites. Les paramètres métaboliques à être évalués comprennent la vitesse et les voies d'élimination et la demi-vie biologique (t½). Doivent également être incluses les techniques d'analyse statistiquement significatives pour la récupération et les limites de détection dans tous les tissus examinés.
Ressources
- AOAC Methods of Analysis (anglais seulement)
- PubMed (U.S. National Library of Medicine, National Institutes of Health) (anglais seulement)
Lignes directrices de l'OCDE pour les essais de produits chimiques
B) Études sur les résidus de la substance mère et de ses métabolites
Les résidus présents dans les tissus du bétail ont le potentiel de pénétrer dans la chaîne alimentaire humaine. Par conséquent, il est important de déterminer dans quelle mesure une substance persiste chez les animaux exposés et dans quels tissus on la retrouve. Doivent également être incluses dans ces exigences en matière de données les techniques analytiques statistiquement significatives pour la récupération et les limites de détection dans les tissus animaux.
Ressources
- AOAC Methods of Analysis (anglais seulement)
- PubMed (U.S. National Library of Medicine, National Institutes of Health) (anglais seulement)
Lignes directrices de l'OCDE pour les essais de produits chimiques
9.0 Effets et devenir dans l'environnement
Les exigences suivantes en matière de données, combinées aux données physico-chimiques, forment la base permettant de prédire ou de déterminer quels milieux environnementaux seront exposés à une substance consécutivement à son rejet (ou au rejet de ses métabolites) et de quelle manière les organismes qu'il contient seront touchés.
A) Tension de vapeur et volatilisation
Il s'agit d'une mesure de la capacité d'un liquide de s'évaporer ou de libérer des vapeurs à une température donnée. D'ordinaire exprimée en millimètres de mercure (mmHg), il s'agit d'un indicateur essentiel du comportement d'un produit liquide, qui indique notamment si le produit aura tendance à se libérer dans l'atmosphère ou à rester dans le sol.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
United States Code of Federal Regulations
B) Hydrolyse
L'un des principaux mécanismes de dégradation des substances dans l'environnement est l'hydrolyse. La mesure dans laquelle cette réaction a lieu dans les conditions normales et les produits de ce type de réaction doivent être décrits.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
C) Photodégradation
Un autre mécanisme important par lequel les substances sont dégradées est leur interaction avec la lumière. On a recours à des essais pour déterminer le potentiel d'une telle dégradation, ainsi que les dérivés possibles formés après ce type de réaction.
Ressources
- AOAC Methods of Analysis (anglais seulement)
- ASTM E896-92(2005)e1 – Standard Test Method for Conducting Aqueous Direct Photolysis Tests (anglais seulement)
D) Adsorption-Désorption
La capacité d'une substance de s'adsorber ou de se « fixer à », puis de se désorber ou détacher d'autres particules ou molécules, a une influence sur sa vitesse de passage ou son temps de séjour dans un milieu environnemental donné. Le sol est un milieu d'adsorption important pour beaucoup de substances.
L'adsorption et la desorption sont souvent facilitées par le pH. Veuillez prendre en considération le pH du sol ou d'un autre milieu.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 106 : Adsorption/désorption selon une méthode d'équilibres successifs
- Essai No 121 : Estimation du coefficient d'adsorption (Koc) sur le sol et les boues d'épuration par chromatographie en phase liquide à haute performance (CLHP)
United States Code of Federal Regulations
AOAC Methods of Analysis
E) Essais simples de biodégradabilité
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 301 : Biodégradabilité Facile
- Essai No 310 : Biodégradabilité facile - dégagement de CO2 dans des flacons hermétiquement clos (essai de l'espace libre au-dessus du liquide)
F) Biotransformation dans le sol
Certaines substances subissent des modifications sous l'effet de la transformation opérée par les micro-organismes (c.-à-d., les activités microbiennes). Ces essais déterminent le potentiel pour la biodégradation, la bioactivation ou la biotransformation de se manifester. Les données obtenues en conditions tant aérobies qu'anaérobies (en présence ou absence d'oxygène) sont utiles, car différents micro-organismes sont concernés dans les processus de biotransformation.
Ressources
- ISO 11266:1994 – Qualité du sol – Lignes directrices relatives aux essais en laboratoire pour la biodégradation de produits chimiques organiques dans le sol sous conditions aérobies
- ISO 15473:2002 – Qualité du sol – Lignes directrices relatives aux essais en laboratoire pour la biodégradation de produits chimiques organiques dans le sol sous conditions anaérobies
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 304A : Biodégradabilité intrinsèque dans le sol
- Essai No 307 : Transformation aérobie et anaérobie dans le sol
- Essai No 308 : Transformation aérobie et anaérobie dans les sédiments aquatiques
- Essai No 312 : Lixiviation sur des colonnes de sol
AOAC Methods of Analysis
G) Biotransformation dans les systèmes aquatiques
Outre la biotransformation dans le sol, les substances peuvent être transformées par des microbes dans le milieu aquatique. Les données obtenues en conditions tant aérobies qu'anaérobies sont utiles, car différents micro-organismes sont concernés dans les processus de biotransformation.
Ressources
- ISO 14592-1:2002 – Qualité de l'eau – Évaluation de la biodégradabilité aérobie des composés organiques présents en faibles concentrations – Partie 1 : Essai en lots de flacons agités avec des eaux de surface ou des suspensions eaux de surface/sédiments
- ISO 14592-2:2002 – Qualité de l'eau – Évaluation de la biodégradabilité aérobie des composés organiques présents en faibles concentrations – Partie 2 : Modèle de cours d'eau à courant continu avec biomasse associée
Lignes directrices de l'OCDE pour les essais de produits chimiques
AOAC Methods of Analysis
H) Demande biochimique en oxygène
Quantité d'oxygène requise par les micro-organismes pour oxyder les composés organiques dans l'eau. Les résultats sont mesurés comme oxygène dissous (OD) en mg d'oxygène par litre (mg O2/L), ou mg d'oxygène par gramme (mg O2/g) de composé. La présence de contaminants organiques peut altérer la qualité de l'eau en réduisant les teneurs en oxygène, ce qui peut nuire aux organismes aquatiques.
Ressources
- ISO 5815-1:2003 – Qualité de l'eau – Détermination de la demande biochimique en oxygène après n jours (DBOn) – Partie 1 : Méthode par dilution et ensemencement avec apport d'allylthiourée
- ISO 5815-2:2003 – Qualité de l'eau – Détermination de la demande biochimique en oxygène après n jours (DBOn) – Partie 2 : Méthode pour échantillons non dilués
- ISO 6060:1989 – Qualité de l'eau – Détermination de la demande chimique en oxygène
Lignes directrices de l'OCDE pour les essais de produits chimiques
I) Toxicité pour les organismes aquatiques
Il est important d'établir quels sont les effets nocifs des substances sur les organismes aquatiques. Bien souvent, les mécanismes de ces effets sont propres aux environnements aquatiques et il est impossible de prédire la toxicité par des essais sur des mammifères en laboratoire. Par ailleurs, les répercussions dues à la perturbation des organismes du bas de la chaîne alimentaire peuvent être très inquiétantes pour l'ensemble de l'écosystème.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 201 : Algues, Essai d'inhibition de la croissance
- Essai No 202 : Daphnia spp. essai d'immobilisation immédiate
- Essai No 203 : Poisson, essai de toxicité aiguë
- Essai No 204 : Poisson, toxicité prolongée étude sur 14 jours
- Essai No 210 : Poisson, essai de toxicité aux premiers stades de la vie
- Essai No 211 : Daphnia magna essai de reproduction
- Essai No 212 : Poisson, essai de toxicité à court terme aux stades de l'embryon et de l'alevin
- Essai No 215 : Poisson, essai sur la croissance des juvéniles
- Essai No 218 : Essai de toxicité sur les chironomes dans un système eau-sédiment chargé
- Essai No 219 : Essai de toxicité sur les chironomes dans un système eau chargée-sédiment
- Essai No 221 : Lemna sp. Essais d'inhibition de la croissance
- Essai No 225 : Essai de toxicité sur Lumbriculus dans un système eau-sédiment chargé
- Essai No 229 : Essai à court terme de reproduction des poissons
- Essai No 230 : Essai de 21 jours sur les poissons: un dépistage à court terme de l'activité œstrogénique, et androgénique et de l'inhibition de l'aromatase
- Essai No 231 : Essai de métamorphose des amphibiens
- Essai No 233 : Essai de toxicité sur le cycle de vie des chironomes dans un système eau-sédiment chargé ou eau chargée-sédiment
United States Code of Federal Regulations
J) Toxicité pour les organismes du sol
Les effets nocifs des substances sur les organismes du sol sont importants car l'intégrité à long terme des sols agricoles peut être compromise par la perturbation des populations et communautés.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 207 : Ver de terre, essais de toxicité aiguë
- Essai No 216 : Micro-organismes du sol : essai de transformation de l'azote
- Essai No 217 : Micro-organismes du sol : essai de transformation du carbone
- Essai No 222 : Essai de reproduction chez le lombric (Eisenia fetida/Eisenia andrei)
- Essai No 226 : Essai de reproduction d'un acarien prédateur (Hypoaspis (Geolaelaps) Aculeifer) dans le sol
- Essai No 232 : Essai de reproduction de collemboles dans le sol
Documents de l'ISO
K) Toxicité pour les oiseaux
Les effets nocifs des substances sur les oiseaux peuvent être importants. Les oiseaux peuvent être plus vulnérables aux quelques substances chimiques que les animaux de laboratoire, donc des essais spécifiques peuvent être nécessaires. Cette différence sur le plan de la tolérance s'explique en partie par des conditions de vie et des agressions environnementales différentes, ainsi que par des différences métaboliques et comportementales.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 205 : Oiseaux, essai de toxicité liée au régime alimentaire
- Essai No 206 : Oiseaux, essai de reproduction
- Essai No 223 : Oiseaux, essai de toxicité orale aiguë
L) Toxicité pour la faume
Ces essais de toxicité sont importants pour déterminer les effets nocifs qu'une substance chimique aura sur les animaux dans les conditions environnementales réelles. Dans le cas de la faune mammifère, les données sur le bétail peut être suffisantes.
Ressources
Lignes directrices de l'OCDE pour les essais de produits chimiques
- Essai No 213 : Abeille domestique, essai de toxicité aiguë par voie orale
- Essai No 214 : Abeille domestique, essai de toxicité aiguë par contact
- Essai No 228 : Détermination de la toxicité d'une substance d'essai pour le développement des mouches du fumier Scathophaga Stercoraria L. (Scathophagidae) et Musca automnalis De Geer (Muscidae)
ASTM International
2.6 Directives relatives à l'évaluation des aliments nouveaux du bétail : origine végétale
L'évaluation d'un ingrédient se fait (sans s'y restreindre) à partir des informations suivantes :
- Si nécessaire, les conditions normales d'enregistrement notamment le pouvoir de signature, l'agent canadien, la demande d'enregistrement dûment remplie et les frais d'enregistrement.
- Étiquetage
Ébauche d'étiquette faisant état du rôle de l'ingrédient et se conformant aux normes et exigences d'emballage et d'étiquetage de la Loi et du Règlement sur les aliments du bétail.
- Description de l'ingrédient
Une description précise de l'ingrédient en vue de préparer une description exacte pour de l'annexe IV ou V (p. ex. 4.2.3 Son de maïs - enveloppe extérieure de grain de maïs, sans la partie amylacée du germe ou avec seulement une très faible quantité de cette dernière).
- Les détails complets de la méthode de fabrication décrivant, si nécessaire, le matériel de départ, les traitements chimiques et/ou physiques et le produit fini (p. ex. 5.3.7. Fin gluten de maïs - résidu séché du maïs après l'extraction du gros de l'amidon et des germes et la séparation du son par les procédés de mouture humide servant à la préparation de l'amidon ou du sirop de maïs, ou par le traitement enzymatique de l'endosperme).
- L'efficacité de l'ingrédient pour l'usage prévu (pour aider à la classification de l'ingrédient aux annexes IV et V).
- Des données documentaires pertinentes provenant d'autres publications (p. ex. les listes de l'Association of American Feed Control Officials, de la National Feed Ingredients Association, du Red Book, du Code of Federal Regulations, du Conseil de l'Europe, etc.).
- Résultats d'enquêtes scientifiques présentés pour étayer les allégations nutritionnelles de l'étiquette devant provenir de recherches : conduites par des chercheurs qualifiés; utilisant des méthodes appropriées; conçues pour faciliter l'analyse statistique; soumises aux analyses statistiques pertinentes; et réalisées dans des conditions semblables à celles qui peuvent exister au Canada.
- Certificat d'analyse permettant d'étayer la garantie, de même que la description des méthodes d'analyse utilisées pour l'ingrédient ou pour un mélange le contenant (p. ex. garantie ou méthode nouvelle).
- S'il y a lieu, une description des méthodes de contrôle de la qualité pour maintenir l'uniformité du produit.
- Description des spécifications du produit, analyses chimiques, concentration en contaminants.
- Échantillon (si nécessaire).
- Renseignements sur l'innocuité (selon le cas)
Les enquêtes scientifiques consistant entre autres, en des analyses chimiques ou de résidus toxiques, des évaluations de la toxicité, des tests nutritionnels, des analyses de résidus dans les tissus, etc., qui sont présentées pour étayer la demande doivent être: conduites par des chercheurs qualifiés; utilisant des méthodes appropriées; conçues pour faciliter l'analyse statistique; soumises aux analyses statistiques pertinentes; et réalisées dans des conditions semblables à celles qui peuvent exister au Canada.
- Des renseignements sur la stabilité du produit, s'il y a lieu.
- Description de méthodes appropriées de détection de concentrations importantes de tout ingrédient, composé, substance ou organisme incorporé intentionnellement ou qui s'y trouve comme contaminant.
1.0 Introduction
1.1 Portée
Ces présentes lignes directrices (section 2.6 Directives relatives à l'évaluation des aliments nouveaux du bétail : origine végétale) s'appliquent aux aliments nouveaux du bétail issus de végétaux, ou de leurs parties ou produits, qui n'ont pas d'antécédents d'utilisation au Canada comme aliments du bétail (c.-à-d. non mentionnés à l'annexe IV ou V du Règlement sur les aliments du bétail) et/ou qui présentent un caractère nouveau qui fait qu'ils ne sont essentiellement équivalents à aucun produit déjà approuvé et offert sur le marché canadien.
La Division des aliments pour animaux de l'ACIA doit donner son autorisation avant la dissémination de tout aliment nouveau du bétail (c.-à-d. avant sa fabrication, sa mise en vente, son importation ou son utilisation).
Ces lignes directrices sont un guide pour la préparation d'une demande d'autorisation de la dissémination d'un aliment nouveau du bétail. Il englobe les critères qui seront pris en considération dans l'évaluation de l'innocuité et de l'efficacité d'un aliment nouveau du bétail. La directive ne vise pas à définir explicitement toutes les données qui pourraient être exigées pour l'évaluation.
Pour plus de renseignements sur les aliments nouveaux du bétail, les démarches relatives aux demandes et les activités de la Division des aliments pour animaux, veuillez consulter le site Web.
Ces lignes directrices servent de guide pour la présentation d'une demande d'autorisation en vue de la dissémination d'un aliment nouveau du bétail, aux termes du Règlement sur les aliments du bétail. Il est à noter que les renseignements diffusés dans ces lignes directrices ne sont pas exhaustifs et seront mis à jour, s'il y a lieu, à la lumière des connaissances scientifiques les plus récentes. Pour obtenir de plus amples renseignements, on recommande fortement aux demandeurs de consulter la Division des aliments pour animaux de l'ACIA. Aux fins de l'interprétation et de l'application de la loi, les demandeurs sont invités à consulter les versions officielles des lois et des règlements pertinents.
1.2 Fondement juridique
La Loi relative aux aliments du bétail et son règlement d'application régissent la fabrication, la vente et l'importation des aliments du bétail au Canada. Tous les aliments doivent être sans danger pour la santé animale, pour la santé humaine (consommation d'aliments renfermant des résidus (à cause du transfert possible de résidus dans l'alimentation humaine, c.-à-d. la viande, le lait et les œufs, et des humains qui travaillent dans cette industrie ou qui sont exposés aux produits de façons fortuite) et pour l'environnement. Ils doivent également se révéler efficaces pour l'utilisation que l'on prévoit en faire. Les ingrédients d'aliments du bétail approuvés sont énumérés et définis aux annexes IV et V du Règlement sur les aliments du bétail. Ces annexes contiennent également les garanties, les normes et les exigences relatives à l'étiquetage se rapportant à ces ingrédients. Les aliments du bétail importés et canadiens doivent satisfaire aux mêmes normes.
Voici le fondements juridique qu'utilise l'ACIA pour réglementer les aliments nouveaux du bétail :
Réglementation des aliments nouveaux du bétail :
Loi relative aux aliments du bétail, L.R. 1985, chapitre F-9
Règlement sur les aliments du bétail, 1983 F-9, DORS/83-593
Recouvrement des coûts :
Avis sur les prix de l'Agence canadienne d'inspection des aliments, Partie I de la Gazette du Canada (05/13/2000)
1.3 Réglementation des aliments nouveaux du bétail
L'ACIA évalue et réglemente de la même manière tous les ingrédients des aliments du bétail, y compris les aliments nouveaux du bétail. Tout ingrédient nouveau (c.-à-d. non mentionné à l'annexe IV ou V du Règlement sur les aliments du bétail) ou modifié de telle sorte qu'il diffère de beaucoup d'un ingrédient classique fait l'objet d'une évaluation et d'une autorisation préalable à la mise en marché. Le but de toutes les évaluations des aliments du bétail est le même : s'assurer avant la mise en marché d'un aliment du bétail que celui-ci sans danger (pour la santé animale, pour la santé humaine [consommation d'aliments renfermant des résidus et exposition professionnelle/fortuite] ainsi que pour l'environnement) et qu'il est efficace pour l'utilisation que l'on prévoit en faire. L'évaluation permet également de s'assurer que les aliments du bétail sont définis avec exactitude dans le Règlement sur les aliments du bétail et qu'ils sont étiquetés de façon appropriée pour indiquer leur innocuité et leur efficacité ainsi que pour assurer la protection des consommateurs.
On considère que les aliments nouveaux du bétail sont des aliments constitués d'un ou de plusieurs organismes, ou de leurs parties ou produits, et qui, selon le cas :
- ne sont pas approuvés en tant qu'aliments du bétail au Canada (c.-à-d. non mentionnés à l'annexe IV ou V du Règlement sur les aliments du bétail);
- présentent un caractère nouveau.
Les annexes IV et V du Règlement sur les aliments du bétail énumèrent tous les ingrédients dont on a approuvé l'utilisation pour la fabrication d'aliments du bétail au Canada. L'annexe IV décrit un éventail d'ingrédients tels que les foins et fourrages, les aliments énergétiques, les aliments protéiques, les produits vitaminés, les produits minéraux, les produits de fermentation et d'autres produits, tandis que l'annexe V se limite aux ingrédients aromatisants.
Par caractère nouveau, on entend une caractéristique transmissible d'un aliment qui n'est pas essentiellement équivalente sur le plan de son usage particulier et de son innocuité à une caractéristique d'un aliment du bétail similaire qui est mentionné à l'annexe IV ou V du Règlement sur les aliments du bétail. Autrement dit, dans le cas des aliments nouveaux du bétail d'origine végétale, un caractère nouveau est une caractéristique transmissible qui est nouvelle dans l'espèce végétale ou un caractère endogène qui a été modifié de façon à être différent des paramètres classiques reconnus pour cette espèce végétale.
Il convient de noter que pour les aliments du bétail à caractères nouveaux, c'est la présence d'un caractère nouveau qui déclenche l'évaluation réglementaire en vertu du Règlement sur les aliments du bétail et non la méthode utilisée pour l'insertion du caractère; ainsi, c'est le végétal et non la méthode qui fait l'objet de l'examen réglementaire. Les aliments nouveaux du bétail peuvent être créés par sélection classique, mutagenèse, fusion cellulaire ou au moyen de techniques de l'ADN recombinant.
Soulignons également que ce qui déclenche l'évaluation réglementaire, c'est la nouveauté et non le risque. Les risques éventuels, tant sur le plan de l'innocuité que de l'efficacité, sont établis pendant l'évaluation du produit.
Les demandeurs qui veulent obtenir des conseils sur la façon de déterminer si leur produit est effectivement un aliment nouveau du bétail peuvent consulter l'annexe II des présentes lignes directrices ou communiquer directement avec les responsables de la Division des aliments pour animaux. Il est fortement recommandé à tout demandeur ayant des difficultés à déterminer la nouveauté de son produit de consulter la Division des aliments pour animaux.
1.4 Principes de l'évaluation
L'objectif des évaluations préalables à la mise en marché des aliments du bétail est de s'assurer que les ingrédients sont sans danger (pour la santé animale, pour la santé humaine [consommation d'aliments renfermant des résidus et exposition professionnelle/fortuite] ainsi que pour l'environnement) et qu'ils sont efficaces pour l'utilisation que l'on prévoit en faire. La Division des aliments pour animaux mène des évaluations d'aliments du bétail en se fondant sur plusieurs principes reconnus à l'échelle internationale.
- Évaluations menées sur une base individuelle
Les aliments nouveaux peuvent varier grandement sur le plan de leurs caractéristiques individuelles. C'est pourquoi il serait peu pratique et coûteux pour les demandeurs d'avoir à appliquer, pour toutes les évaluations, un seul et unique ensemble d'exigences en matière de données pour démontrer l'efficacité et l'innocuité de leurs produits. Comme les exigences en matière de données sont plutôt établies d'après les caractéristiques propres à chaque produit, le demandeur peut se concentrer uniquement sur l'atteinte d'exigences pertinentes à son produit.
- Familiarité
Le degré de soutien scientifique requis dans un ensemble de données est fonction de la complexité du produit en question et du degré de familiarité associé au produit/caractère. Si la Division des aliments pour animaux est très familière avec les caractéristiques d'un produit et/ou d'un caractère donné en ce qui concerne son utilisation comme aliment du bétail, la quantité de données nécessaires pour démontrer l'innocuité et l'efficacité du produit pourra être moins élevée ou être définie de manière plus concise.
- Approche comparative
Les évaluations d'aliments nouveaux du bétail sont effectuées à l'aide d'une approche comparative. La comparaison d'un aliment nouveau du bétail avec des produits ayant des antécédents d'utilisation comme aliments du bétail fait ressortir les similitudes et les différences qui existent entre l'aliment nouveau du bétail et des aliments déjà présents sur le marché.
Les comparaisons de données faites à l'intérieur de l'ensemble de données présenté doivent être effectuées à l'aide d'au moins un homologue approprié. Des homologues appropriés doivent avoir des antécédents d'utilisation au Canada comme aliments du bétail. Pour les aliments du bétail à caractères nouveaux, les demandeurs doivent typiquement effectuer des comparaisons à l'aide d'un homologue non modifié. Autrement dit, les demandeurs doivent utiliser pour leurs comparaisons des variétés souches classiques et/ou des ségrégants négatifs, lorsqu'il y a lieu dans le cas de végétaux obtenus à l'aide de techniques de l'ADN recombinant.
- Justification scientifique valable
La présentation d'une justification scientifique valable (soutenue par des données appropriées ou des renvois à la littérature) peut annuler l'obligation d'effectuer certaines des études dont il est question dans ces présentes lignes directrices ou permettre un rapprochement avec d'autres études scientifiques valables.
- Poids de la preuve
Le processus d'évaluation est fondé sur le poids de la preuve. Cela signifie que la somme des données fournies sert à déterminer si un aliment nouveau du bétail doit être autorisé ou ne doit pas l'être.
- Définition et étiquetage des aliments du bétail
Une des étapes du processus d'approbation des aliments nouveaux du bétail est de s'assurer qu'ils sont définis avec exactitude dans le Règlement sur les aliments du bétail et qu'ils sont étiquetés de façon appropriée pour indiquer leur innocuité et leur efficacité et pour assurer la protection des consommateurs. Dans certains cas, un aliment nouveau du bétail peut correspondre à une définition déjà établie et dans d'autres cas, on doit modifier une définition déjà établie ou élaborer une nouvelle définition.
Principes supplémentaires s'appliquant aux aliments du bétail à caractères nouveaux :
- Équivalence substantielle
L'équivalence substantielle repose sur la comparaison des propriétés du végétal modifié dont est dérivé un aliment du bétail présentant un caractère nouveau à celles d'un homologue approprié. En tenant compte des effets intentionnels et non intentionnels, on identifie les similitudes et les différences qui existent entre le végétal modifié et son homologue. Les aspects du végétal modifié qui se révèlent équivalents à ceux de l'homologue sont acceptés, et l'évaluation de l'innocuité se concentre sur les différences. La notion d'équivalence substantielle est canalisée par des organismes internationaux tels que l'OCDE et pour l'FAO/l'OMS.
Dans le cadre de l'évaluation d'un aliment du bétail, on compare ses données moléculaires, nutritionnelles et toxicologiques à celles d'un homologue approprié. L'identification et la détermination ultérieure des concentrations en principaux éléments nutritifs, en facteurs antinutritionnels, en toxines et en allergènes endogènes sont un aspect important de la détermination de l'équivalence substantielle. Les documents de consensus de l'OCDE relatifs à chaque culture végétale (anglais seulement) peuvent être des références utiles dans la détermination des principaux éléments à examiner.
- Effets non intentionnels
Le processus d'évaluation tient compte de la probabilité que des effets non intentionnels puissent survenir dans le végétal modifié et que ces effets aient une incidence sur l'efficacité et/ou l'innocuité de l'aliment du bétail dérivé de ce végétal.
1.5 Détermination des exigences à remplir en matière de données
Les sections 2 à 8 des présentes lignes directrices décrivent les catégories d'exigences en matière de données à remplir par les demandeurs qui présentent une demande concernant un aliment nouveau du bétail. Les demandeurs doivent tenir compte de chaque section, mais la manière de remplir les exigences peut varier. Il leur faudra dans certains cas procéder à la collecte et à l'analyse de données brutes, mais il suffira parfois de présenter une justification scientifique valable soutenue par des publications scientifiques.
Les demandeurs devraient communiquer avec les responsables de la Division des aliments pour animaux dès les premières étapes de mise au point d'un aliment nouveau du bétail pour obtenir des éclaircissements sur les besoins en information particuliers à satisfaire pour l'évaluation de l'innocuité et de l'efficacité d'un produit. Il convient de noter que d'autres exigences réglementaires s'appliquent lorsqu'un demandeur souhaite faire des allégations concernant un aliment du bétail une fois qu'il a été autorisé. On peut trouver les directives concernant les allégations relatives aux aliments du bétail au chapitre 2, section 2.2, des Directives réglementaires : procédures d'enregistrement et normes d'étiquetage.
1.6 Qualité des données
Les données fournies à l'appui d'une demande doivent être d'un niveau acceptable pour publication dans une revue scientifique examinée par des pairs. Les études doivent être conçues et menées conformément aux concepts et principes scientifiques reconnus et, lorsque cela est pertinent, aux bonnes pratiques de laboratoire. Toutes les substances d'essais utilisées pour la production des données doivent être représentatives de la forme finale de l'aliment du bétail. Les témoins doivent également convenir à l'atteinte des objectifs de l'étude. Les études doivent être menées par du personnel de recherche qualifié qui utilise des méthodes validées. Il faut également fournir des descriptions complètes des méthodes utilisées pour produire les données présentées, y compris des procédures d'assurance de la qualité/contrôle de la qualité et de la sensibilité. Le cas échéant, les données doivent être analysées à l'aide de techniques d'analyse statistique appropriées. Les données primaires doivent être disponibles sur demande. Toutes les parties de la demande doivent être bien lisibles, et une attention particulière doit être accordée aux gels et aux transferts analytiques (p. ex. gels PAGE en présence de SDS, transferts Northern, transferts Southern et transferts Western). Les références scientifiques utilisées pour étayer l'ensemble de données doivent être fournies avec la demande.
Afin d'aider les demandeurs à préparer des données de qualité, l'ACIA a élaboré, en collaboration avec Santé Canada et l'Animal and Plant Health Inspection Services de l'USDA (United States Department of Agriculture), une liste de contrôle à l'intention des vérificateurs concernant les techniques analytiques utilisées.
À la lumière de l'adoption précipité en cours sur le séquençage du génome entier (SGE) dans les dossiers de soumission préalables à la mise sur le marché, un document d'orientation a été développé décrivant les principes et les bonnes pratiques que les promoteurs devraient considérer pour organiser et présenter leurs données. Les promoteurs sont encouragés à consulter les « Lignes directrices sur la présentation des données issues du séquençage du génome entier (SGE) au soutien de l'évaluation préalable à la mise en marché des aliments nouveaux destinés à la consommation humaine et animale et aux végétaux à caractères nouveaux » lorsque des analyses utilisant le SGE font parties de leur soumission.
1.7 Présentation de l'information
Les demandeurs doivent élaborer leur demande comme il le ferait pour préparer un document scientifique destiné à être publié. D'ordinaire, une demande comprendra les points suivants.
- Introduction générale à la demande.
- Pour chaque élément de données
- Introduction
- Description de la collecte des données (remarque : des données brutes sont d'ordinaire requises)
- Résultats
- Conclusions
- Conclusion générale de la demande
Il convient de noter que, dans la conclusion, les demandeurs doivent indiquer clairement de quelle façon les résultats renvoient à l'innocuité et à l'efficacité du produit lorsque celui-ci est utilisé comme aliment du bétail.
1.8 Procédures pour présenter une demande
On incite fortement les demandeurs à présenter une demande d'autorisation pour la dissémination d'un aliment nouveau du bétail bien avant la date prévue pour sa mise en marché. Les demandeurs doivent suivre les procédures de dépôt d'une demande exposées au chapitre 1 des Directives réglementaires : procédures d'enregistrement et normes d'étiquetage.
Il est à noter que les présentes lignes directrices n'ont pas pour objet de définir explicitement toutes les données qui peuvent être requises dans le cadre de l'évaluation. La Division des aliments pour animaux pourrait, au besoin, demander que des renseignements supplémentaires lui soient fournis. Les demandeurs devraient communiquer avec les responsables de la Division des aliments pour animaux dès les premières étapes de mise au point d'un aliment nouveau du bétail pour obtenir des éclaircissements sur les renseignements particuliers dont la Division des aliments pour animaux a besoin pour effectuer une évaluation.
Les demandeurs doivent déposer une version papier de leur demande et sont incités à également déposer celle-ci sur support informatique (disque compact).
1.9 Harmonisation avec d'autres organismes de réglementation
Lorsqu'un aliment nouveau du bétail issu d'un végétal est raisonnablement susceptible d'être disséminé dans l'environnement canadien et/ou d'être utilisé dans l'alimentation humaine, le Bureau de la biosécurité végétale de l'ACIA et/ou la Section des aliments nouveaux de Santé Canada peuvent également exiger une demande pour l'autorisation de cet aliment en tant que végétal doté d'un caractère nouveau (VCN) et/ou qu'aliment nouveau destiné l'alimentation humaine. Il revient alors au demandeur, et non à la Division des aliments pour animaux, d'entrer en contact avec ces bureaux et de déterminer si une demande doit être déposée.
On conseille aux demandeurs souhaitant obtenir une autorisation de dissémination d'un aliment nouveau du bétail au Canada de demander simultanément l'autorisation de leur produit au Canada et aux États-Unis, si ce produit y est aussi réglementé. L'obtention de telles autorisations peut réduire au minimum les mouvements transfrontaliers de matériel non autorisé.
Lorsqu'un aliment nouveau du bétail est issu d'un végétal que l'on considère également comme un VCN et/ou un aliment nouveau qui pourrait être utilisé pour l'alimentation humaine, les autorisations pour son utilisation dans l'alimentation humaine, son utilisation dans l'alimentation animale et sa dissémination dans l'environnement seront accordées d'une manière harmonisée. On pourra ainsi limiter les possibilités que des produits non approuvés n'entrent dans l'environnement canadien ou dans les chaînes canadiennes de production d'aliments destinés à l'alimentation animale ou humaine. Les demandeurs ainsi que les importateurs doivent savoir que, le cas échéant, des approbations sont requises de la part des trois organismes de réglementation concernés avant la dissémination d'un produit dans l'environnement ou son utilisation dans l'alimentation humaine ou animale. Notez que l'harmonisation est seulement requise lorsque le produit déclenche plus d'un type d'évaluation. Autrement dit, une autorisation harmonisée n'est pas requise lorsqu'un aliment nouveau du bétail n'est pas un aliment nouveau pour la consommation humaine ou un VCN.
Lorsque des produits issus de végétaux sont conçus pour être utilisés soit pour l'alimentation humaine, soit pour l'alimentation animale, soit pour la moléculture végétale, les organismes de réglementation doivent quand même se consulter afin d'évaluer les risques associés à la dissémination du produit dans une chaîne de production d'aliments à laquelle il n'est pas destiné.
Soulignons qu'une fois les évaluations terminées, le demandeur est avisé par écrit par l'ACIA et Santé Canada (lettres distinctes) de leurs décisions respectives concernant la demande.
1.10 Renseignements confidentiels
Les renseignements fournis à l'ACIA par les demandeurs pour obtenir l'autorisation de la dissémination des aliments du bétail nouveaux peuvent être protégés conformément à l'article 20 de la Loi sur l'accès à l'information.
Toutes les demandes de tierces parties concernant des renseignements sont assujetties à la Loi sur l'accès à l'information et à la Loi sur la protection des renseignements personnels du gouvernement fédéral. Pour de plus amples renseignements, il suffit de consulter le service de l'Accès à l'information et protection des renseignements personnels (AIPRP) de l'ACIA, en composant le 613-773-2342.
2.0 Caractérisation de la source végétale
Les données doivent être présentées en quantités suffisantes pour que l'on puisse caractériser l'aliment nouveau du bétail ainsi que le végétal duquel cet aliment est issu, puis effectuer des comparaisons avec des homologues appropriés.
On peut répondre à la plupart des questions concernant la caractérisation du produit en utilisant les données obtenues pendant la phase de mise au point du produit.
2.1 Organismes sources, hôtes et donneurs
Pour les aliments du bétail dérivés d'une source végétale qui n'a pas d'antécédents d'utilisation pour l'alimentation du bétail, il est essentiel de procéder à la caractérisation de la source végétale si l'on veut évaluer l'efficacité et l'innocuité de l'aliment nouveau du bétail.
Pour les aliments du bétail à caractères nouveaux, l'information concernant les organismes hôtes et donneurs utilisés dans la mise au point du végétal modifié peut nous aider à un peu mieux comprendre ce qu'il faut évaluer. Dans certains cas, la caractérisation de ces organismes est assez simple, notamment lorsqu'il s'agit d'espèces végétales classiques. Par contre, les organismes donneurs qui n'ont pas d'antécédents d'utilisation pour l'alimentation du bétail ou ceux qui contiennent des toxines, des substances allergènes ou des facteurs antinutritionnel doivent faire l'objet d'une caractérisation plus détaillée.
L'information à fournir pour les organismes sources, hôtes et donneurs comprend notamment, sans y être limitée, ce qui suit.
- Noms vernaculaires ou usuels; noms scientifiques et taxonomie.
- Évaluation critique de la capacité de l'organisme de produire/contenir des composés potentiellement toxiques (p. ex. métaux lourds, pesticides), des composés antinutritionnels et des substances allergènes endogènes.
- Données toxicologiques disponibles sur l'organisme.
- Renseignements sur les antécédents d'utilisation de l'organisme ou d'organismes apparentés pour l'alimentation du bétail.
2.2 Caractérisation du végétal
Les renseignements concernant les caractéristiques et l'utilisation d'un végétal pour l'alimentation du bétail sont des composants essentiels de la demande.
Fournir les renseignements suivants :
- Désignations du végétal utilisées dans la demande.
- Description de l'utilisation prévue du végétal pour l'alimentation du bétail.
- Liste des autres organismes gouvernementaux, au Canada et à l'étranger, qui ont été avertis de la mise au point de l'aliment nouveau du bétail; description de l'objet de l'avis; liste des pays dans lesquels l'aliment nouveau du bétail a obtenu une autorisation réglementaire.
Pour ce qui est des aliments du bétail à caractères nouveaux, fournir également les renseignements suivants :
- Description du caractère nouveau.
- Description de l'utilisation prévue du caractère nouveau.
- Description de l'évaluation de la part du demandeur pour déterminer s'il y a des effets secondaires prévus ou des effets non intentionnels sur la plante hôte.
Cette évaluation tient compte de l'occurrence possible d'effets non intentionnels dans le végétal modifié, qu'ils découlent du processus de modification ou qu'ils surviennent en raison de la modification proprement dite. La caractérisation phénotypique globale du végétal modifié peut être utilisée comme preuve pour démontrer l'absence d'effets non intentionnels ou pour identifier de tels effets.
Les deux méthodes suivantes sont souvent utilisées pour caractériser les végétaux :
- comparaison de profils compositionnels avec un homologue approprié, et
- comparaison de paramètres phénotypiques/agronomiques avec un homologue approprié.
Il est à noter que les demandeurs ne sont pas tenus de fournir des données phénotypiques ou agronomiques à la Division des aliments pour animaux si ces renseignements ont déjà été fournis à l'ACIA dans le cadre de l'évaluation d'un VCN.
Afin de respecter cette exigence, les demandeurs peuvent se référer aux données qu'ils ont fournies pour adresser la section 3 des présentes lignes directrices (données compositionnelles) et aux données qu'ils ont fournies dans le cadre de l'évaluation de l'innocuité environnementale du végétal modifié.
- Caractérisation et évaluation des effets secondaires et des effets non intentionnels qui ont été observés dans le végétal hôte (relativement à l'innocuité et à l'efficacité de l'aliment du bétail qui en est dérivé).
2.3 Historique des modifications et du développement
Pour ce qui est des aliments du bétail à caractères nouveaux, fournir l'information suivante :
- Description de la méthode de sélection/d'insertion du caractère.
Les diverses méthodes d'insertion de caractères présentent des caractéristiques différentes pour ce qui est des effets intentionnels et non intentionnels. En connaissant la méthode utilisée pour insérer un caractère, on peut mieux comprendre ce qui doit faire l'objet d'une évaluation dans le végétal modifié.
- Description de la généalogie du végétal modifié. Indiquer quelles générations ont été utilisées pour produire les données fournies.
- Description des critères de sélection utilisés tant aux étapes initiales de mise au point que pendant le processus de croisement subséquent.
- Preuves à l'appui de la transmission héréditaire et de la stabilité de chaque modification génétique des végétaux.
- Pour les végétaux qui possèdent une fertilité mâle, femelle ou les deux, fournir des données démontrant les formes et la stabilité de la transmission et de l'expression des caractères nouveaux. Si le nouveau caractère ne peut pas être directement mesuré par un essai, il est parfois nécessaire d'examiner a) la transmission de l'insert d'ADN et b) l'expression de l'ARN.
- Pour les végétaux qui sont infertiles ou pour lesquels il est difficile de produire des semences (p. ex. les pommes de terre androstériles multipliées par voie végétative), fournir des données qui démontrent que le caractère transgénique se maintient de façon stable et s'exprime au cours de la multiplication végétative, et ce, sur un certain nombre de cycles appropriés pour la culture.
- Dans le cas d'un végétal allopolyploïde, désignation du génome parental dans lequel la modification génétique se manifeste.
2.4 Description du caractère nouveau
Pour ce qui est des aliments du bétail à caractères nouveaux, il faut fournir les renseignements suivants en ce qui concerne le caractère nouveau et tout matériel nouvellement exprimé, qu'il s'agisse de matériel exogène ou de matériel indigène modifié :
- Description des antécédents d'utilisation du caractère nouveau.
- Caractérisation du fonctionnement du caractère nouveau.
Les renseignements concernant le fonctionnement du caractère nouveau peuvent nous amener à un peu mieux comprendre ce qui doit faire l'objet d'une évaluation. Il faut définir le fondement génétique du caractère (p. ex. le gène inséré ou la mutation) et décrire les effets en aval de cette modification génétique qui entraîne l'apparition du caractère nouveau. Pour les produits issus de techniques de l'ADNr, tenir compte de tout le matériel génétique potentiellement transféré au génome du plan hôte et caractériser l'ADN à transférer (voir annexe I).
- Renseignements détaillés sur le ou les produits géniques, y compris leur activité, leurs produits de dégradation, leurs sous-produits et les voies métaboliques affectées (y compris les processus altérés d'accumulation et de stockage) découlant de l'insertion du caractère nouveau.
- Indication à savoir si l'expression génique est constitutive ou inductible et description des agents d'induction. Indiquer si le caractère s'exprime dans les tissus appropriés, d'une façon et à des niveaux qui correspondent aux séquences régulatrices commandant l'expression.
- Caractérisation de l'expression du produit génique dans toutes les parties végétales qui peuvent être consommées par le bétail. Il est parfois nécessaire de déterminer les niveaux des métabolites du produit génique.
- Si la concentration protéique est inférieure à la limite de détection : fournir des données sur l'ARNm.
- Pour les végétaux résistants aux virus, où les transgènes proviennent d'un génome viral : outre l'analyse des protéines transgéniques, indiquer les concentrations d'ARN transgéniques dans les tissus qui correspondent aux régions régulatrices commandant l'expression du transgène.
- Pour les végétaux modifiés pour altérer spécifiquement l'accumulation d'une protéine ou d'un ARNm : fournir des données sur la concentration de la protéine cible uniquement. Si la concentration de cette dernière est inférieure à la limite de détection, indiquer les concentrations d'ARNm.
- Probabilité d'exposition de l'homme, du bétail et de l'environnement, y compris les concentrations estimées et la voie la plus probable d'exposition aux produits nouveaux, aux produits de leur dégradation et à leurs sous-produits.
- Potentiel d'effets négatifs pour l'homme et le bétail, y compris l'exposition aux toxines et aux facteurs antinutritionnels, ainsi que l'action irritante et le pouvoir allergène pour l'homme (par rapport à l'exposition fortuite/professionnelle).
- Risque de transfert de tout produit nouveau dans le fumier et les effets éventuels de ce transfert.
2.5 Gènes marqueurs
Il faut identifier et caractériser tous les marqueurs de transformation utilisés dans la mise au point du végétal relativement aux caractères nouveaux (section 2.4 des présentes lignes directrices). Les effets secondaires de ces marqueurs sur la biochimie, la physiologie et le métabolisme secondaire du végétal hôte doivent également être caractérisés; il faut aussi donner des renseignements sur les conséquences relatives à l'efficacité et à l'innocuité.
Comme on ajoute fréquemment des antibiotiques aux aliments du bétail, il faut déterminer la probabilité de leur inactivation pendant l'entreposage par suite de l'activité de tout gène marqueur de résistance à un antibiotique.
On doit éviter d'utiliser des gènes marqueurs conférant une résistance aux antibiotiques qui ont une importance clinique.
3.0 Données nutritionnelles
Les ingrédients des aliments nouveaux du bétail produits à partir du végétal doivent être décrits, y compris les données relatives à la transformation et les taux d'alimentation estimatifs pour l'ingrédient et ses sous-produits.
La composition en éléments nutritifs et en facteurs antinutritionnels des principaux éléments et sous-produits du végétal utilisé pour alimenter le bétail doit être prise en considération. Par exemple, outre la composition des grains, on devrait déterminer celle du plant entier de maïs ou de l'ensilage de maïs. On devrait aussi s'arrêter aux différents sous-produits dans lesquels sont concentrés les éléments nutritifs ou les facteurs antinutritionnels.
Il faut comparer la composition de l'ingrédient de l'aliment nouveau du bétail à celle du même ingrédient provenant d'un homologue approprié. Ces comparaisons doivent être fondées sur l'analyse d'échantillons représentatifs obtenus de parcelles appropriées au cours d'une ou de plusieurs saisons de croissance. Il est également acceptable de comparer la composition nutritionnelle publiée des équivalents génétiques ou des homologues les plus rapprochés. Les données doivent démontrer l'uniformité ou la variabilité de la composition du produit final et doivent comprendre l'analyse ou la caractérisation des produits géniques ou des métabolites qui ont été modifiés (p. ex. dans le cas des protéines, toute modification postérieure à la traduction est digne d'intérêt).
Les études scientifiques présentées à l'appui de l'évaluation nutritionnelle doivent être : conçues pour faciliter l'analyse statistique; analysées au moyen de méthodes statistiques convenables; dans le cas des aliments pouvant être cultivés au Canada, effectuées dans des conditions semblables à celles que l'on s'attend de trouver au Canada. Le plan expérimental doit comprendre au moins deux emplacements, deux groupes (le végétal doté d'un caractère nouveau et un témoin) et trois réplicats. Les échantillons représentatifs ne doivent pas être regroupés pour l'analyse. L'analyse des éléments nutritifs et des facteurs antinutritionnels doit être faite en double, conformément aux méthodes de l'AOAC International ou à d'autres méthodes reconnues.
Les données brutes et les imprimés d'analyse statistique doivent accompagner la demande. Il faut évaluer les différences statistiques de composition quant à leur signification biologique.
3.1 Composition nutritionnelle
Fournir au moins les renseignements suivants :
- Teneur en protéines brutes
- Teneur en matières grasses brutes et en cendre
- Teneur en fibres brutes ou en fibres au détergent acide (FDA) ou en fibres au détergent neutre (FDN).
- Présence naturelle ou fortuite de facteurs antinutritionnels dont on peut raisonnablement prévoir la présence (p. ex. phytates, inhibiteurs de trypsine, alcaloïdes et pigments, etc.)
En fonction de l'évaluation précédente et de l'utilisation prévue de l'aliment du bétail, les données suivantes peuvent également être requises :
- Teneur en protéines vraies, composés azotés non protéiques et acides aminés
- Composition quantitative et qualitative en lipides totaux, c.-à-d. en composés saponifiables et non saponifiables, et teneur en acides gras
- Composition en glucides, p. ex. teneur en glucides, en tanins, en polysaccharides non glucidiques et en lignines.
- Teneur en vitamines
- Teneur en minéraux
Pour les aliments du bétail à caractère nouveaux, documents de consensus de l'OCDE sur les éléments nutritifs et les facteurs antinutritionnels clés que l'on doit analyser dans diverses espèces végétales devraient être consultés.
Les résultats inhabituels ou imprévus des analyses des éléments nutritifs ou des facteurs antinutritionnels doivent faire l'objet d'une analyse plus approfondie.
Dans le cas des aliments nouveaux du bétail dont la composition nutritionnelle (p. ex. les acides aminés ou les acides gras) ou la fonctionnalité (p. ex. la digestibilité et la biodisponibilité) a été intentionnellement modifiée, il faut effectuer des analyses et des comparaisons des éléments nutritifs et des facteurs antinutritionnels ainsi que des comparaisons avec des témoins appropriés de la façon décrite susmentionnée. Les données à l'appui des allégations liées à la modification doivent également être fournies. Il faut également traiter des conséquences potentielles sur l'innocuité et l'efficacité que peuvent avoir les modifications nutritionnelles intentionnelles.
4.0 Expositions alimentaires
Il faut fournir des détails complets sur la quantité prévue de l'aliment nouveau dans le régime complet du bétail. Les estimations de l'exposition alimentaire à l'aliment nouveau peuvent jouer un rôle capital dans la détermination des données nécessaires à l'évaluation de l'innocuité et de l'efficacité. En outre, il peut être nécessaire d'ajouter des données sur les effets de l'âge des animaux et de l'espèce animale en ce qui concerne l'utilisation prévue de l'aliment nouveau. Les aliments présents en faibles concentrations dans un régime complet peuvent être moins préoccupants que ceux que l'on destine à être des composants importants du régime. Les demandeurs doivent également traiter des impacts que l'aliment nouveau du bétail peut avoir sur la formulation des rations.
Pour ce qui est des aliments du bétail à caractères nouveaux, la quantité prévue de l'aliment dans le régime complet du bétail est d'ordinaire fondée sur l'utilisation habituelle d'un homologue non modifié. Les estimations de l'exposition alimentaire doivent être prudentes en ce sens qu'il faut tenir compte de situations où l'homologue non modifié est remplacé à 100 %.
Si un aliment du bétail doté d'un caractère nouveau est ou peut être utilisé d'une façon qui entraînera une exposition alimentaire différente de celle correspondant à l'homologue non modifié, cette possibilité doit être indiquée et il faut également traiter de l'importance du nouveau profil d'utilisation.
Si un aliment du bétail doté d'un caractère nouveau présente des changements intentionnels au niveau de sa composition, il faut indiquer de quelle façon ce changement affectera la santé et la production animales.
5.0 Données toxicologiques
La toxicité des organismes hôtes et donneurs et/ou du caractère nouveau introduit tant pour le bétail (par l'apport alimentaire) que pour les humains (à la suite de la consommation de produits alimentaires issus du bétail (c.-à-d., viande, lait et œufs) et d'une exposition professionnelle/fortuite) doit être prise en considération.
5.1 Toxines endogènes
- Dans le cas d'aliments nouveaux qui constituent de nouveaux ingrédients d'aliments du bétail, fournir les données sur les concentrations de toxines endogènes présentes dans le végétal à partir duquel l'aliment nouveau du bétail est fabriqué, puis comparer ces données aux concentrations présentes dans les ingrédients pour aliments du bétail approuvés.
Pour ce qui est des aliments du bétail à caractères nouveaux, comparer le végétal modifié et un homologue approprié en regard des concentrations de toxines endogènes présentes dans les organismes hôtes et donneurs.
5.2 Matériel nouvellement exprimé
Pour les aliments du bétail à caractère nouveaux, fournir les renseignements suivants sur le matériel nouvellement exprimé, qu'il s'agisse de matériel exogène introduit ou de matériel indigène modifié :
- Comparaison des séquences d'acides aminés de la protéine nouvellement exprimée aux séquences d'acides aminés de toxines connues afin de déterminer toute homologie éventuelle. Préciser la ou les bases de données utilisées pour effectuer la recherche.
- Description de toute similitude du matériel nouvellement exprimé découlant de la modification de produits de source traditionnelle.
- Stabilité digestive de la protéine nouvellement exprimée.
- Stabilité thermique de la protéine nouvellement exprimée.
- Si des préoccupations découlent de l'évaluation des données fournies, il peut être nécessaire d'effectuer autres études toxicologique.
Si des protéines d'origine bactérienne sont utilisées à la place de protéines produites par des végétaux dans les études de la toxicité potentielle de la protéine nouvelle, il faut alors démontrer l'équivalence biochimique, structurelle et fonctionnelle des deux protéines.
Se reporter au chapitre 2, sections 2.3 à 2.5, des Directives réglementaires : procédures d'enregistrement et normes d'étiquetage, pour de plus amples renseignements sur les exigences liées aux évaluations traditionnelles de la toxicité des aliments du bétail.
6.0 Données sur l'allergénicité
Il faut tenir compte de l'allergénicité potentielle des organismes hôtes et donneurs et/ou des caractères nouveaux pour l'humain, à la suite de la consommation de produits alimentaires issus du bétail (c.-à-d. viande, lait et œufs) ou d'une exposition professionnelle/fortuite.
6.1 Allergènes endogènes
- Dans le cas d'aliments nouveaux du bétail qui constituent de nouveaux ingrédients, fournir des données sur les concentrations en allergènes que l'on sait présentes dans le végétal à partir duquel l'aliment nouveau du bétail est fabriqué, puis comparer ces concentrations avec celles présentes dans des ingrédients d'aliments du bétail approuvés.
Pour ce qui est des aliments du bétail à caractères nouveaux, comparer le végétal modifié et un homologue approprié en regard des concentrations en allergènes endogènes que l'on sait présentes dans les organismes hôtes, les organismes donneurs et les lignées parentales.
6.2 Protéines nouvellement exprimées
Actuellement, il n'existe pas d'essais auxquels on pourrait, sans crainte d'erreur, se fier pour prévoir la réaction allergique à une protéine nouvellement exprimée. C'est pourquoi il faut appliquer une approche au cas par cas et par étape (tel l'arbre de décision de 2000 ou de 2001 de la FAO/OMS dans l'évaluation de l'allergénicité possible de protéines nouvellement exprimées.
Fournir les renseignements suivants pour les aliments du bétail à caractères nouveaux en ce qui concerne les protéines nouvellement exprimées, qu'il s'agisse de matériel exogène introduit ou de matériel indigène modifié :
- Comparaison de la séquence des acides aminés de la protéine nouvellement exprimés à celle d'allergènes connus. La portée de la recherche des acides aminés contigus devrait reposer sur des motifs scientifiques pour réduire au minimum le risque de faux négatifs et de faux positifs. On devrait utiliser des méthodes éprouvées de recherche et d'évaluation. Préciser la ou les bases de données utilisées pour effectuer la recherche.
- Réactivité de la protéine nouvelle avec l'immunoglobine-E (IgE) du sérum sanguin d'individus allergiques si la protéine nouvelle est issue d'une source allergène connue ou si elle possède une homologie de séquences importante avec un allergène connu.
- Stabilité digestive de la protéine nouvellement exprimée.
- Stabilité thermique de la protéine nouvellement exprimée.
7.0 Essais alimentaires sur des animaux de ferme et/ou de laboratoire
Il est parfois nécessaire d'effectuer des essais alimentaires sur des animaux de ferme et/ou de laboratoire pour remplir les exigences de l'évaluation de l'innocuité et de l'efficacité des aliments nouveaux du bétail issus de végétaux. Ces essais doivent être effectués en utilisant du matériel représentatif du matériel qui sera utilisé au Canada. Dans certains cas, dans le cadre d'une évaluation de l'innocuité, il est parfois peu pratique de réaliser des essais alimentaires avec des végétaux entiers en raison de variations dans la composition et de difficultés à administrer des quantités suffisantes de la substance en question à l'animal. Par contre, il faut consentir tous les efforts possibles pour caractériser l'ensemble du végétal, les parties du végétal ou les protéines produites in vitro par rapport à des homologues appropriés ou à des comparateurs équivalents.
Dans le cadre de l'évaluation de l'innocuité d'un aliment nouveau du bétail issu d'un végétal, il est parfois nécessaire de réaliser des essais alimentaires sur des animaux de ferme et/ou de laboratoire pour répondre à des préoccupations toxicologiques découlant d'une évaluation de données présentées conformément aux exigences des sections 2.1 à 6.0 des présentes lignes directrices, y compris les données sur la toxicité aiguë.
Des essais alimentaires peuvent également être nécessaires pour résoudre des questions liées à l'efficacité de l'aliment nouveau du bétail dérivé de végétaux (p. ex. corroboration de son adéquation nutritionnelle et de la biodisponibilité de ses éléments nutritifs). La nécessité de tels essais peut être déterminée d'après l'évaluation des données présentées pour satisfaire aux exigences des sections 2.1 à 6.0 des présentes lignes directrices.
Dans le cas d'une modification de la composition nutritionnelle ou de la fonctionnalité de l'aliment du bétail, il faut effectuer des études in vitro et/ou in vivo de l'innocuité et de l'efficacité de l'aliment.
Il faut obtenir une autorisation de dissémination d'un aliment nouveau du bétail à des fins de recherche auprès de la Division des aliments pour animaux avant de mener des essais alimentaires en utilisant des aliments nouveaux du bétail au Canada. Pour obtenir les directives concernant les demandes d'autorisation de dissémination à des fins de recherche, consultez le chapitre 5 des Directives réglementaires : procédures d'enregistrement et normes d'étiquetage.
8.0 Évaluation de l'innocuité pour l'environnement
Une évaluation de l'impact potentiel de l'aliment nouveau du bétail sur l'environnement est requise si l'un des composants de cet aliment nouveau est disséminé, y compris les excréments du bétail qui consomme l'aliment.
Cette évaluation peut également porter sur les points suivants, s'ils n'ont pas été évalués par l'ACIA dans le cadre d'une revue pour un VCN :
- Possibilité que le végétal se comporte comme une mauvaise herbe agricole ou envahisse des habitats naturels.
- Flux génétique possible du végétal vers des espèces sauvages apparentées dont la descendance hybride pourrait avoir davantage tendance à devenir une mauvaise herbe ou à être envahissante.
- Possibilité que le végétal devienne une mauvaise herbe.
- Incidence possible du végétal ou de ses produits géniques sur des espèces non ciblées, y compris les humains.
- Incidence possible du végétal sur la biodiversité.
9.0 Méthodes de détection et d'identification
Dans certaines situations où il est nécessaire de vérifier la conformité aux conditions d'autorisation, l'ACIA peut demander que les renseignements suivants soient présentés :
- des méthodes appropriées de détection et d'identification de l'aliment du bétail nouveau d'origine végétale;
- un consentement écrit visant à fournir à l'ACIA du matériel de référence pertinent appuyant ces méthodes.
Si l'ACIA détermine qu'une méthode de détection et d'identification est nécessaire dans le cadre de la soumission d'un aliment du bétail nouveau d'origine végétale, elle fournira une orientation sur les renseignements qui doivent être fournis.
Certains renseignements sur la détection et l'identification d'un aliment du bétail nouveau d'origine végétale peuvent être protégés en vertu des dispositions de la Loi sur l'accès à l'information. Toute demande d'accès à ces renseignements est assujettie non seulement à Loi sur l'accès à l'information, mais aussi à la Loi sur la protection des renseignements personnels.
10.0 Décision réglementaire
D'après l'information reçue et après évaluation des répercutions possibles de l'aliment nouveau sur bétail, les humains et l'environnement, la Division des aliments pour animaux procède de la manière suivante. Elle :
- autorise la mise en marché de l'aliment nouveau du bétail lorsque les risques sont minimes (il est à noter que des conditions peuvent s'appliquer aux autorisations relativement à la gestion du risque);
- refuse d'autoriser la dissémination de l'aliment nouveau du bétail lorsque son utilisation pose un risque inacceptable, y compris lorsque l'on ne dispose pas de suffisamment de données pour démontrer l'innocuité et/ou l'efficacité de celui-ci; ou
- s'adresse au demandeur pour obtenir l'information supplémentaire dont elle a besoin pour achever l'évaluation (« lettre de déficiences »), puis prend une des décisions susmentionnées. La Division des aliments pour animaux considère que le dossier est clos si la lettre d'observation reste sans réponse un an après la date de son envoi.
Lorsqu'un aliment nouveau du bétail, y compris un aliment doté d'un caractère nouveau, est autorisé (c.-à-d. qu'il est mentionné à l'annexe IV ou V ou que l'on a déterminé qu'il est essentiellement équivalent à un ingrédient déjà mentionné dans les annexes), il n'est plus considéré comme un aliment nouveau.
11.0 Publication de la décision
Lorsqu'une décision réglementaire a été prise afin d'autoriser un aliment nouveau du bétail qui constitue un nouvel ingrédient, on ajoute une définition de l'ingrédient à l'annexe IV ou V ou V du Règlement sur les aliments du bétail.
Lorsqu'une décision réglementaire a été prise concernant un aliment du bétail à caractère nouveau, qui ne constitue pas un nouvel ingrédient, la Division des aliments pour animaux affiche sur le site Web de l'ACIA un document de décision ou le dossier d'évaluation de l'aliment en question. Ce document explique la décision réglementaire prise par la Division des aliments pour animaux et par le Bureau de la biosécurité végétale (lorsque l'aliment nouveau du bétail issu d'un végétal est également un VCN). Santé Canada publie un document de décision distinct expliquant sa décision réglementaire concernant l'utilisation de l'aliment pour l'alimentation humaine.
12.0 Besoin de nouveaux renseignements
Si, à un moment quelconque, le demandeur apprend l'existence de nouveaux renseignements concernant le risque pour l'environnement, le bétail ou les humains qui pourrait découler de la dissémination de l'aliment nouveau du bétail, celui-ci doit fournir immédiatement cette information à l'ACIA.
D'après cette nouvelle information, peu importe la source, l'ACIA procédera à une réévaluation du risque pour l'environnement et des impacts possibles sur celui-ci - y compris le risque pour la santé humaine ou animale et les impacts possibles sur celle-ci - lié à l'utilisation de l'aliment du bétail. L'ACIA peut : imposer d'autres conditions relativement à la dissémination ou à l'utilisation de l'aliment du bétail; modifier les conditions se rapportant aux autorisations accordées ou les annuler; exiger du demandeur qu'il cesse toute dissémination ou utilisation de l'aliment du bétail et qu'il prenne les mesures nécessaires pour éliminer ou limiter le risque.
13.0 Définitions
- ADN porteur :
- l'ADN utilisé pour accélérer la préparation ou la transformation du matériel génétique dans une plante, mais qui ne fait pas partie de la construction.
- Aliment du bétail :
- Substances ou mélanges de substances renfermant notamment des acides aminés, des produits antioxydants, des glucides, des condiments, des enzymes, des lipides, des éléments minéraux, des produits azotés et non protéiques, des protéines, des vitamines, des liants pour agglomérés, des colorants, des agents moussants ou des aromatisants, lorsque cette substance ou ce mélange est fabriqué ou vendu pour servir, directement ou après adjonction à une autre de ces substances ou de ces mélanges, aux fins suivantes, ou est décrit comme devant servir :
- à la consommation par les animaux de ferme,
- à l'alimentation des animaux de ferme, ou
- à empêcher ou corriger des désordres nutritifs chez les animaux de ferme. (Loi relative aux aliments du bétail).
- Aliment nouveau du bétail :
- Aliment constitué d'un ou de plusieurs organismes, de leurs parties ou de leurs produits et qui, selon le cas :
- n'est pas mentionné aux annexes IV ou V, ou
- présente un caractère nouveau (Règlement sur les aliments du bétail).
- Animaux de ferme :
- Chevaux, bovins, ovins, caprins, porcins, renards, poissons, visons, lapins et volailles, ainsi que les autres animaux désignés animaux de ferme pour l'application de la Loi relative aux aliments du bétail.
- Biotechnologie :
- application des sciences et de l'ingénierie à l'utilisation directe ou indirecte d'organismes vivants ou de leurs parties ou produits, sous leur forme naturelle ou modifiée (Loi canadienne sur la protection de l'environnement).
- Caractère :
- caractéristique ou ensemble de caractéristiques phénotypiques conférées au végétal récepteur par des modifications génétiques précises.
- Caractère nouveau :
- caractère d'un aliment du bétail qui :
- d'une part, a été intentionnellement sélectionné, créé ou incorporé dans celui-ci par une modification génétique particulière, et
- d'autre part, en ce qui a trait à son usage particulier et à son innocuité tant pour l'environnement que pour la santé humaine et animale, sur la foi d'une justification scientifique valable, n'est essentiellement équivalent à aucun caractère d'un aliment semblable mentionné aux annexes IV ou V (Règlement sur les aliments du bétail).
- Citations de bases de données :
- sources d'information publiquement accessible sur les séquences de nucléotides ou de protéines. Les cinq bases de données couramment utilisées et leur adresse de site Web sont présentées dans la section des références.
- Construction :
- Fragment d'ADN génétiquement manipulé (p. ex. plasmide) qui contient, sans y être limité, des séquences d'ADN à intégrer dans le génome de la plante cible.
- Effets non intentionnels :
- Outre les effets intentionnels causés par une insertion/mutation de séquences définies d'ADN, il peut y avoir des effets non intentionnels causés par l'acquisition de caractères supplémentaires ou la perte ou la modification de caractères existants. Les effets non intentionnels peuvent être bénéfiques, nuisibles ou neutres pour la santé du végétal et l'innocuité pour la santé humaine ou animale.
- Environnement :
- Ensemble des éléments naturels de la terre (y compris l'air, l'eau, le sol, toutes les couches de l'atmosphère, toutes les matières organiques et inorganiques ainsi que les êtres vivants) et les systèmes naturels en interaction qui comprennent les éléments susmentionnés (Règlement sur les aliments du bétail). L'environnement comprend les écosystèmes naturels et aménagés, dont les écosystèmes agricoles.
- Équivalence substantielle :
- Équivalence d'un aliment du bétail dérivé d'un végétal, à l'intérieur d'une espèce végétale donnée, en ce qui a trait à son usage particulier et à son innocuité tant pour l'environnement que pour la santé humaine et animale, aux caractères de la même espèce qui, actuellement et de façon générale, sont considérés comme sans danger au Canada, d'après des bases scientifiques valables.
- Évaluation de l'innocuité :
- Comprend l'identification, l'estimation, l'évaluation et la gestion du risque.
- Familiarité :
- Connaissance des caractéristiques d'une espèce végétale donnée et expérience basée sur son utilisation au Canada.
- Flux génétique :
- Transfert de matériel génétique par croisement entre individus de deux populations de la même espèce (ou d'une espèce apparentée), qui modifie la composition du pool génétique de la population réceptrice.
- Homologue :
- Un ou des aliments du bétail sélectionnés par le demandeur et auxquels on comparera l'aliment nouveau. L'homologue choisi devrait, si c'est possible, être l'équivalent génétique le plus rapproché et peut être un aliment nouveau du bétail déjà évalué et autorisé. Comme, parmi les variétés d'une espèce, il existe une gamme de caractéristiques, la comparaison avec plusieurs homologues peut montrer que l'aliment nouveau possède des caractéristiques se situant à l'intérieur de la plage habituelle des variations présentées par l'espèce. Si l'équivalent génétique le plus rapproché n'est pas semblable à l'aliment nouveau (p. ex. végétal dont on a délibérément modifié la composition), on pourra aussi comparer cet aliment avec les produits qu'il est censé imiter.
- Insert :
- Partie d'une construction qui est intégrée au génome de la plante réceptrice.
- Irritant :
- Agent capable de provoquer un état anormal d'excitation ou de sensibilisation dans une partie du corps d'un humain ou d'un animal.
- Modification génétique :
- Toute intervention intentionnelle se traduisant par un changement des caractères héréditaires d'un organisme. Cela comprend, mais non exclusivement, l'amélioration génétique traditionnelle, les techniques de recombinaison des acides nucléiques, la variation somaclonale, l'électroporation, la mutagenèse et d'autres techniques similaires.
- Région codante :
- Séquence d'ADN qui peut être traduite pour produire une protéine.
- Région non codante :
- Séquences d'ADN situées à l'extérieur d'un cadre ouvert de lecture et non traduites pour faire partie d'une protéine. Les régions non codantes peuvent comprendre les régions d'ancrage dites « scaffold attachment regions » ou « SAR », des promoteurs, des séquences de tête, des activateurs, des introns, des terminateurs et toute autre séquence utilisée pour l'expression des gènes, soit dans le végétal, soit dans d'autres hôtes, comme les origines de réplication, les éléments de transposons, les bordures d'ADN transféré (ADN-T), les séquences lox, etc.
- Stabilité :
- Aptitude du caractère à s'exprimer dans la lignée végétale modifiée et les lignées qui en sont issues, de façon constante, fiable et prévisible.
- Vecteur :
- Molécule d'ADN à réplication autonome dans laquelle on insère de l'ADN étranger et que l'on propage ainsi dans une cellule hôte.
- Végétal à caractères nouveaux (VCN) :
- Végétaux possédant des caractéristiques qui ne sont pas présentes chez les végétaux de la même espèce dont il existe déjà en culture au Canada des populations stables ou qui présentent un caractère bien en dehors de la plage habituelle des caractéristiques similaires existantes chez cette espèce végétale dans les populations stables en culture au Canada.
- Végétal transgénique :
- Végétal chez lequel au moins un gène, une construction génétique ou un caractère a été introduit à l'aide de techniques de l'ADN recombinant, y compris l'insertion de matériel génétique provenant de la même espèce ou d'une espèce différente.
14.0 Références
GenBank (anglais seulement) : Collection annotée de toutes les séquences d'ADN publiquement accessibles, conservée par la National Institutes of Health (NIH).
Banque de données japonaises sur l'ADN (anglais seulement) : Banque d'ADN officiellement certifiée du Japon, qui recueille des séquences d'ADN des chercheurs.
Séquences de nucléotides du EMBL (anglais seulement) : Base de données sur des séquences d'ADN et d'ARN prélevées des publications scientifiques, des demandes de brevets et directement présentées par des chercheurs et des groupes de séquençage.
FAO : La FAO dirige des efforts internationaux pour vaincre la famine. La FAO sert de tribune neutre où les nations se rencontrent sur un même pied d'égalité pour négocier des accords et débattre de politiques. La FAO est également une source de connaissances et d'informations.
Banque de données sur les allergènes du FARRP (anglais seulement) : Banque de données contenant une liste d'allergènes uniques connus et présumés identifiés grâce à des recherches dans les banques de données sur les protéines qui sont publiquement accessibles.
OCDE : L'Organisation de coopération et de développement économiques (OCDE) est une organisation internationale qui reconnaît les principes d'une démocratie représentative et d'une économie de libre marché. L'OCDE publie des rapports qui renferment de l'information technique utile à l'évaluation réglementaire des produits issus des biotechnologies. Ces documents sont reconnus par les pays membres de cette organisation.
Banque de données sur les séquences des protéines SWISS-PROT (anglais seulement) : Base de données sur des séquences de protéines produites en collaboration par Amos Bairoch (Université de Genève) et l'EBI.
Annexe I : Exigences relatives à la caractérisation moléculaire des aliments du bétail à caractères nouveaux dérivés de végétaux mis au point à l'aide de techniques de l'ADN recombinant :
Dans le cas de végétaux mis au point à l'aide de techniques de l'ADN recombinant, fournir l'information suivante.
- Pour chaque événement issu d'une méthode transgénique, il faut attribuer à chaque lignée un identificateur unique, conformément aux directives figurant dans le document de l'OCDE intitulé OECD Guidance for the Designation of a Unique Identifier for Transgenic Plants - PDF (40 ko) (anglais seulement) (ENV/JM/MONO(2002)7).
- Décrire l'élément génétique responsable du caractère nouveau.
- Préciser l'objectif de la modification, p. ex. tolérance à un herbicide nouveau, androstérilité/restauration.
- Décrire la méthode utilisée pour introduire le ou les caractères nouveaux et fournir les références pertinentes.
- Information sur la nature et la source de l'ADN utilisé pour modifier le végétal (p. ex. ADN porteur, vecteurs, plasmides auxiliaires).
- Dans le cas des transformations effectuées à l'aide d'Agrobacterium, désignation de la souche d'Agrobacterium utilisée pendant le processus de transformation et la méthode ayant servi à désarmer le vecteur plasmidique Ti; précision à savoir si Agrobacterium a été éliminé du tissu transformé.
- Dans le cas des systèmes de transformation autre que ceux ayant recours à Agrobacterium :
- indication à savoir si le système utilise un organisme pathogène ou des séquences d'acide nucléique provenant d'un pathogène;
- le cas échéant, manière dont les séquences associées à la pathogenèse ont été éliminées avant la transformation.
- Décrire le matériel génétique potentiellement dérivé du végétal hôte.
- Sommaire sur tous les éléments génétiques compris dans le vecteur, y compris les régions codantes et les séquences non codantes de fonction connue. Pour chaque élément génétique, reproduction de citations dans lesquelles ces séquences fonctionnelles ont été décrites, isolées et caractérisées (il est acceptable de fournir des citations provenant de bases de données publiquement accessibles), incluant l'information suivante :
- taille et identité de l'élément génétique;
- emplacement et orientation dans le vecteur;
- fonction dans le végétal;
- source (nom scientifique et usuel de l'organisme donneur);
- indication à savoir si l'élément génétique cause des maladies ou des dommages aux végétaux ou à d'autres organismes ou si ses produits sont des intoxicants, des allergènes, des facteurs de pathogénicité ou des irritants connus.
- Identification de changements particuliers vis-à-vis des acides aminés s'il y a eu une modification importante qui affecte la séquence des acides aminés de la protéine qui doit être exprimée dans le végétal. Indiquer si ces changements sont connus ou si l'on s'attend à ce qu'ils affectent la modification post-traductionnelle ou des sites importants pour la structure ou la fonction du produit génique.
- Établissement d'une carte du vecteur avec l'emplacement des séquences décrites susmentionnées. Cette carte doit être suffisamment précise pour que l'on puisse l'utiliser dans l'analyse des données à l'appui de la caractérisation de l'ADN. Elle peut notamment indiquer l'emplacement des sites de restriction et des régions utilisées comme sondes et/ou comme amorces pour la réaction en chaîne de la polymérase (PCR).
- Sommaire sur tous les éléments génétiques compris dans le vecteur, y compris les régions codantes et les séquences non codantes de fonction connue. Pour chaque élément génétique, reproduction de citations dans lesquelles ces séquences fonctionnelles ont été décrites, isolées et caractérisées (il est acceptable de fournir des citations provenant de bases de données publiquement accessibles), incluant l'information suivante :
- Caractériser l'ADN inséré dans le végétal, y compris ce qui suit :
- nombre de sites d'insertion;
- données qui démontrent si des copies complètes ou partielles ont été insérées dans le génome du végétal
- pour les régions non codantes associées à l'expression des régions codantes :
- indication à savoir si oui ou non des promoteurs végétaux ont été insérés de façon intacte dans les régions codantes dont ils sont censés régir l'expression;
- analyse de l'ADN est parfois nécessaire pour les introns, les séquences de tête, les terminateurs et les améliorateurs de cassettes exprimables par le végétal;
- analyse de l'ADN est parfois nécessaire pour les promoteurs et les autres régions régulatrices associées aux cassettes exprimées par des bactéries.
- Dans le cas des régions non codantes pour lesquelles on ne connaît aucune fonction végétale et qui ne sont pas associées avec l'expression des régions codantes :
- analyse de l'ADN est parfois nécessaire pour certaines séquences de fonctions connues (p. ex. ori V et ori-322, bordures de l'ADN-T d'Agrobacterium et éléments bactériens transposables);
- analyse de l'ADN non requise pour toute séquence restante du squelette plasmidique lorsque le plasmide est bien caractérisé.
- Lorsque c'est pertinent, données sur la séquence du matériel inséré et sur les régions environnantes (l'information sur les séquençages peut être de nature informative dans certains cas et peut servir à caractériser entièrement un insert d'ADN partiel ou réarrangé).
La caractérisation de la protéine ou de l'ARN peut ne pas être nécessaire pour les fragments de construction génétique non sensés être fonctionnels chez le végétal (p. ex. fragments de gènes marqueurs sélectionnables et commandés par des promoteurs bactériens).
- Tenir compte de la possibilité qu'une protéine de fusion puisse être produite si un fragment d'une région codante conçu pour s'exprimer dans le végétal est détecté et dans quels tissus il peut se situer.
Annexe II : Directive pour la détermination de la nouveauté
Il incombe au demandeur de déterminer s'il a mis au point un aliment nouveau du bétail ou non. Le demandeur qui souhaite déterminer si un aliment du bétail dérivé d'un végétal est nouveau ou non doit se poser certaines questions fondamentales. Les voici.
Q1. L'aliment du bétail dérivé d'un végétal est-il inscrit à l'annexe IV ou V du Règlement sur les aliments du bétail?
Non, aliment nouveau du bétail.
Pour les aliments du bétail à caractères nouveaux :
Q2. L'aliment du bétail est-il dérivé d'un végétal présentant une ou plusieurs caractéristiques qui sont nouvelles ou hors de la plage habituelle de caractéristiques pour cette espèce végétale?
Oui, aliment nouveau du bétail
Les demandeurs doivent se servir de leur expertise et de la littérature scientifique pertinente pour déterminer la nature d'un caractère sélectionné d'après l'expérience acquise au Canada afin d'établir s'ils ont créé un aliment du bétail doté d'un caractère nouveau. Tout changement important dans les caractéristiques agronomiques, nutritionnelles ou compositionnelles d'un végétal qui est nouveau ou hors de la plage de caractéristiques reconnues pour une espèce donnée constitue un caractère nouveau, ce qui oblige le demandeur à présenter une demande d'autorisation de dissémination de l'aliment du bétail dérivé de ce végétal. Ainsi, des aliments dérivés d'une nouvelle lignée de blé dont l'augmentation de rendement est similaire aux augmentations de rendement observées dans les lignées de blé cultivées au Canada ne seraient pas considérés comme des aliments nouveaux du bétail. Des aliments nouveaux du bétail dérivés d'une nouvelle lignée de canola résistant aux insectes et affichant une résistance de beaucoup supérieure à celle que présentent les végétaux cultivés actuellement au Canada constitueraient des aliments du bétail à caractères nouveaux. Des aliments du bétail dérivés d'une nouvelle lignée de soja présentant une augmentation importante de la concentration en méthionine présenteraient un caractère nouveau.
Q3. L'aliment du bétail est-il dérivé d'un végétal qui est un descendant, obtenu par croisement intra-spécifique, d'un végétal déjà autorisé pour servir dans l'alimentation du bétail?
Oui, pas nouveau
Lorsqu'un végétal est autorisé comme aliment du bétail, tous les descendants de ce végétal modifié et ses lignées soeurs, lesquelles ont été dérivées du végétal modifié original, sont également autorisés comme aliments du bétail, à la condition que le demandeur prouve que :
- les usages prévus sont similaires;
- d'après la caractérisation, ces végétaux n'affichent aucun caractère nouveau supplémentaire et sont essentiellement équivalents, quant à leur usage particulier et à leur innocuité pour l'environnement ainsi que pour la santé humaine et animale, à des végétaux présentement utilisés comme aliments du bétail; et
- le ou les caractères déjà évalués et autorisés s'expriment dans une mesure similaire à celle des individus de la lignée autorisée.
L'ACIA peut demander au demandeur de fournir des preuves à l'appui de ses conclusions.
Q4. L'aliment du bétail est-il dérivé d'un végétal qui est un descendant, obtenu par croisement inter-spécifique, d'un végétal déjà autorisé pour servir à alimenter le bétail?
Oui, vraisemblablement nouveau
Pour les aliments du bétail à caractères nouveaux, c'est la présence du caractère nouveau qui déclenche l'évaluation réglementaire en vertu du Règlement sur les aliments du bétail, et non la méthode utilisée pour insérer le caractère. Ainsi, le transfert d'un caractère qui a déjà été évalué et autorisé dans un végétal récepteur par croisement inter-spécifique peut se traduire par la création d'un aliment nouveau du bétail. Cela signifie que l'espèce réceptrice doit faire l'objet d'une évaluation et d'une autorisation avant que l'on puisse l'utiliser comme aliment du bétail.
Une fois que la Division des aliments pour animaux a donné son autorisation concernant l'utilisation de cet aliment pour le bétail, le demandeur peut être dispensé de l'obligation de présenter une demande auprès de la Division des aliments pour animaux pour obtenir une autorisation concernant des lignées supplémentaires dérivées à l'aide de moyens similaires (c.-à-d. croisement inter-spécifique), à la condition que le demandeur prouve ce qui suit :
- les usages prévus sont similaires;
- d'après la caractérisation, ces végétaux n'affichent aucun trait nouveau supplémentaire et sont essentiellement équivalents, quant à leur usage particulier et leur innocuité pour l'environnement et pour la santé humaine et animale, à des végétaux présentement utilisés comme aliments du bétail;
- les caractères déjà évalués et ayant été autorisés s'expriment à un degré similaire à celui observé chez d'autres lignées autorisées.
L'ACIA peut demander au demandeur de fournir des preuves à l'appui de ses conclusions.
Q5. L'aliment du bétail est-il dérivé d'un végétal possédant des caractères déjà autorisés et qui ont été empilés intentionnellement?
Oui, notification de la Division des aliments pour animaux requise
La Division des aliments pour animaux doit être avisée au moins 60 jours avant l'utilisation prévue comme aliment du bétail des végétaux présentant des caractères empilés découlant de croisements intentionnels intra- ou inter-spécifiques entre des végétaux nouveaux déjà autorisés comme aliments du bétail. À la suite de la réception de l'avis du demandeur, la Division des aliments pour animaux enverra une lettre (dans les 60 jours suivant la réception de l'avis) informant le demandeur des préoccupations qu'elle peut avoir concernant l'utilisation de ce végétal avec caractère empilé pour l'alimentation du bétail. La Division des aliments pour animaux se réserve le droit de demander et de passer en revue des données à l'appui de l'utilisation sécuritaire du végétal modifié comme aliment du bétail. L'empilage de caractères ayant des exigences de gestion potentiellement incompatibles, la présence d'effets synergétiques négatifs possibles ou, encore, l'altération de l'utilisation du végétal comme aliment du bétail sont tous des facteurs qui peuvent rendre une évaluation nécessaire. Tant que toutes les préoccupations concernant l'alimentation du bétail ne sont pas résolues, le végétal modifié ne peut être utilisé en tant qu'aliment du bétail.
Q6. L'aliment du bétail est-il dérivé d'un végétal qui est une re-transformation ou une remutation d'un végétal déjà autorisé à être utilisé pour l'alimentation du bétail?
Oui, peut être nouveau
Par re-transformation, on entend la transformation d'un végétal possédant une construction génétique identique à celle d'un végétal déjà autorisé de la même espèce et qui confère le même caractère. La re-mutation est quant à elle considérée comme la mutation du même gène dans un végétal déjà autorisé de la même espèce et qui lui confère le même caractère. De tels végétaux peuvent ne pas exiger le dépôt d'une demande auprès de la Division des aliments pour animaux si :
- la méthode est identique à celle déjà utilisée;
- les utilisations prévues sont similaires;
- selon la caractérisation, ces végétaux n'affichent aucun caractère nouveau supplémentaire et sont essentiellement équivalents - quant à leur utilisation spécifique et à leur innocuité pour l'environnement et pour la santé humaine et animale - à des végétaux présentement utilisés pour l'alimentation du bétail; et
- les caractères déjà évalués et autorisés s'expriment dans une mesure similaire à celle observée dans la lignée autorisée.
Il est à noter que si un demandeur détermine qu'un aliment du bétail n'est pas nouveau, l'information à l'appui de son allégation doit être conservée et présentée sur demande à l'ACIA.
Il est fortement recommandé de consulter la Division des aliments pour animaux pour toute difficulté concernant la détermination de la nouveauté d'un produit.
2.7 Directives relatives à l'évaluation des nouveaux aliments du bétail : produits d'origine microbienne
1 Introduction
1.1 Portée
Ces lignes directrices (Section 2.7 des directives réglementaires RG-1, Procédures d'enregistrement et normes d'étiquetage) s'appliquent aux nouveaux aliments pour animaux composés de microorganismes et aux produits qui en sont dérivés qui n'étaient auparavant pas autorisées par l'Agence canadienne d'inspection des aliments (ACIA) à des fins d'utilisation dans les aliments pour le bétail au Canada ou qui possèdent des caractères nouveaux.
Tous les nouveaux aliments du bétail doivent être autorisés par la Division des aliments pour animaux (DAA) de l'ACIA avant de ne pouvoir être distribués (c.-à-d., fabriqués, mis en vente, importés ou utilisés comme aliment pour bétail).
Cette section de la RG-1 fournit de l'orientation pour la préparation d'une demande d'autorisation de distribution d'un nouvel aliment microbien. Elle comprend des critères qui seront considérés lors de l'évaluation de l'innocuité et de l'efficacité d'un aliment à caractère nouveau. Cette section ne vise pas à définir explicitement toutes les données qui pourraient être nécessaires au cours de l'évaluation.
Pour en savoir davantage, consultez les nouveaux aliments, le processus d'application et les activités de la DAA.
Veuillez noter que les renseignements fournis dans ces lignes directrices ne sont pas exhaustifs et seront mis à jour périodiquement s'il y a lieu afin de représenter les connaissances scientifiques actuelles. Pour plus de détails, les demandeurs sont fortement encouragés à consulter la DAA. Aux fins d'interprétation et d'application de la Loi, nous recommandons aux demandeurs de consulter la version officielle des lois et règlements pertinents.
1.2 Produits d'aliments microbiens
Les produits microbiens communément utilisés dans les aliments du bétail sont classés dans l'une de deux catégories :
- les produits microbiens viables ou PMV (bactéries, levures et moisissures), y compris les inoculants pour ensilage qui aident à la préservation de plantes fourragères par moyen de la fermentation, ou les microbiens alimentés en direct (MAD) qui servent à améliorer le rendement des animaux. Les inoculants pour ensilage et les MAD peuvent être composés d'une souche de microorganismes ou plus. L'innocuité et la viabilité de chaque souche individuelle contenue dans un produit mélangé doivent être évaluées et chacune des souches doit être homologuée avant qu'un produit ne puisse être évalué et homologué. Des renseignements supplémentaires concernant les inoculants pour ensilage sont disponibles dans la Section 3.9, Exigences d'enregistrement des additifs fourragers, et plus de renseignements concernant les MAD sont disponibles dans la Section 3.22, Produits microbiens et levures viables,
- les produits microbiens non viables, y compris les produits dérivés de produits microbiens viables, comme des enzymes, des acides aminés, des vitamines et des ingrédients aromatisants, et les sous-produits et les résidus provenant de processus de fermentation, comme les drêches et la biomasse de levure restantes après la production de bière ou la fabrication d'éthanol. Des renseignements supplémentaires concernant les produits dérivés de produits microbiens sont disponibles dans la Section 3.6, Renseignements sur l'enregistrement pour les suppléments enzymatiques et les aliments mélangés contenant des suppléments enzymatiques. Plus de renseignements concernant les sous-produits de fermentation et les résidus sont disponibles dans la RG-6, Drêches de distillerie provenant de la production d'éthanol utilisées dans les aliments du bétail
1.3 Classification des produits microbiens viables (aliments pour animaux, médicaments ou produits biologiques vétérinaires)
Les produits microbiens viables ou les produits qui en sont dérivés à des fins de consommation directe par des animaux sont classifiés comme étant soit un aliment pour animaux, un médicament ou un produit biologique vétérinaire selon les allégations de l'étiquette du produit. C'est à la compagnie fabriquant le produit qu'il incombe de déterminer et de soutenir la classification adéquate de ses produits de manière satisfaisante.
Lorsque des allégations sur une étiquette, dans des campagnes publicitaires d'entreprises ou dans de la documentation scientifique indiquent que le produit alimentaire microbien viable est un médicament ou un produit vétérinaire biologique, nous recommandons aux demandeurs de consulter l'organisme gouvernemental adéquat (c.-à-d., la Direction des médicaments vétérinaires de Santé Canada ou le Centre canadien des produits biologiques vétérinaires de l'ACIA). Pour plus de renseignements sur la classification de produits microbiens viables, y compris sur les types d'allégations associées à chacune des classifications et sur la façon de communiquer avec les organismes pertinents, veuillez consulter la Section 3.22 du RG-1, Produits microbiens et levures viables.
Plus de renseignements concernant la classification de médicament comparativement à un aliment sont aussi disponibles dans le Document d'orientation sur la classification des médicaments vétérinaires et des aliments du bétail, disponible sur le site Web de Santé Canada.
1.4 Réglementation de nouveaux aliments du bétail
La DAA évalue et réglemente tous les ingrédients pour aliments pour animaux, y compris les nouveaux aliments du bétail, selon les mêmes critères. Tout ingrédient qui est nouveau (c.-à-d. qui ne figure pas déjà dans les annexes IV ou V du Règlement de 1983 sur les aliments du bétail), ou qui a été modifié de sorte qu'il soit très différent d'un ingrédient conventionnel doit subir une évaluation et une autorisation préalables à la mise en marché. L'objectif de toutes les évaluations des aliments du bétail est le même : assurer l'innocuité (pour la santé des animaux; pour la santé des humains, en raison des contacts avec des résidus alimentaires ou l'exposition des travailleurs et l'exposition fortuite; et pour l'environnement) et l'efficacité de l'ingrédient aux fins de son utilisation prévue avant sa mise en marché. L'évaluation assure aussi que les aliments pour animaux soient définis de façon précise dans le Règlement sur les aliments du bétail et étiquetés adéquatement à des fins d'utilisation sécuritaire et efficace et afin de protéger les consommateurs.
1.5 Recherches effectuées à l'aide de nouveaux produits d'aliments microbiens
Si de nouveaux microorganismes, ou des parties ou des produits qui en sont dérivés, ne sont pas prêts à être commercialisés, mais seront utilisés dans des essais d'alimentation du bétail ou dans des projets pilotes d'essai de recherche de mise au point d'aliments du bétail, la DAA doit en être avisée et une demande d'Autorisation pour la dissémination de nouveaux aliments à des fins de recherche doit être soumise. Veuillez consulter le Chapitre 5 de la RG-1 pour plus de renseignements.
1.6 Principes d'évaluation
Pour des renseignements généraux concernant l'évaluation des demandes d'enregistrement de produits d'aliments du bétail, veuillez consulter le Chapitre 1 de la RG-1.
La DAA effectue des évaluations de la salubrité de nouveaux aliments du bétail selon des critères de familiarité et d'équivalence substantielle. La familiarité et l'équivalence substantielle sont deux concepts essentiels qui ont été créés par l'OCDE (1993) et qui ont par la suite été élaborés davantage par la FAO et l'OMS (2000).
La familiarité peut être définie comme étant la connaissance des propriétés et des caractéristiques d'un produit microbien ainsi que de ses utilisations et applications dans les aliments du bétail au Canada, c.-à-d., ceux qui se trouvent dans les annexes IV ou V du Règlement sur les aliments du bétail. L'équivalence substantielle est fondée sur la comparaison d'un nouveau produit à un produit homologue adéquat en tenant compte des effets souhaités et non souhaités. Un degré d'équivalence peut être établi pour de nouveaux produits microbiens si les utilisations prévues, la composition et les propriétés fonctionnelles du produit sont essentiellement équivalentes et que les souches de production sont aussi essentiellement équivalentes en matière de la salubrité envers la santé des animaux, la santé des humains et l'environnement. Une fois que la familiarité et un degré d'équivalence ont été établis, le processus d'évaluation de l'innocuité est concentré sur les différences entre le nouveau produit et son homologue et sur les effets de ces différences sur l'innocuité du nouveau produit.
Des considérations essentielles dans le cadre de l'évaluation de nouveaux aliments de sources microbiennes comprennent l'innocuité du microorganisme de production et des produits microbiens envers les humains, les animaux et l'environnement. Certains points à considérer au cours de l'évaluation comprennent :
- les effets potentiels du transfert horizontal de gènes dans l'estomac de microorganismes et dans l'environnement
- les interactions avec la microflore gastro-intestinale
- la persistance dans l'estomac
- les effets potentiels sur les humains et sur l'environnement par l'excrétion de microorganismes viables dans les matières fécales du bétail
- la capacité de survie dans des microorganismes viables dans le tube digestif, ce qui pourrait affecter la qualité de la viande dérivée des animaux qui consommeront l'aliment
Dans les cas où il est possible que des microorganismes contaminent de la viande, Santé Canada pourrait demander une évaluation de la salubrité du produit en tant que nouvel aliment.
1.7 Processus de demande
Des renseignements administratifs généraux concernant les procédures de demande pour l'enregistrement d'aliments pour animaux peuvent être retrouvés dans le Chapitre 1, de la RG-1, Exigences d'administration pour évaluations avant la mise en marché et demandes d'enregistrement pour aliments du bétail. Des exigences particulières se trouvent dans la partie 2 ci-dessous et dans la liste de vérification se trouvant en pièce jointe.
Certains produits ou ingrédients microbiens possèdent des exigences de données particulières qui sont nécessaires afin d'appuyer des allégations d'innocuité ou d'efficacité. Veuillez consulter les documents d'orientation pertinents pour plus de renseignements :
- Section 3.6 – Renseignements sur l'enregistrement pour les suppléments enzymatiques et les aliments mélangés contenant des suppléments enzymatiques
- Section 3.9: Exigences d'enregistrement des additifs fourragers
- Section 3.22 – Produits microbiens et levures viables
- RG-6 Directives réglementaires : Drêches de distillerie provenant de la production d'éthanol utilisées dans les aliments du bétail
2 Caractérisation du produit microbien
Le dossier de présentation doit comprendre un résumé afin de fournir au lecteur un aperçu du produit, ainsi que son utilisation, ses applications et ses effets sur l'espèce ciblée, l'identité de l'organisme de production et, lorsque possible, l'identité du microorganisme donneur et les méthodes de modification.
Tous les travaux expérimentaux doivent être effectués conformément à des principes scientifiques solides et à de bonnes pratiques de laboratoire. Les méthodes utilisées pour générer les données expérimentales doivent être soumises ou un renvoi doit leur être effectué dans le cas d'une publication.
Toutes les données soumises à l'appui de l'évaluation de l'innocuité, y compris les tableaux, les cartes, les figures, les graphiques ainsi que les gels et transferts analytiques devraient être de haute qualité, comparables à ce qui est acceptable par des journaux scientifiques examinés par des pairs de bonne réputation. Une attention particulière devrait être portée à la sensibilité et aux particularités des méthodes analytiques. Les mesures de contrôle et les documents de référence utilisés au cours des analyses ainsi que les données démontrant la capacité de reproduction, la sensibilité ou la précision d'une méthode doivent être soumis. Les analyses statistiques doivent être menées selon des techniques adéquates et les données brutes doivent être disponibles sur demande. Les études de documentation soumises à l'appui de l'innocuité d'un produit doivent comprendre toutes les références citées dans le texte. Lorsque des données provenant d'un document publié sont citées à l'appui de l'innocuité d'un produit, un exemplaire de la publication ou un site Web du périodique en question comprenant l'intégralité de l'article en format textuel doit être fourni.
Les listes de vérification des examinateurs (veuillez consulter l'annexe II de ce document) fournissent de l'orientation aux demandeurs pour la préparation de données de qualité. Nous recommandons que les demandeurs examinent les listes de vérification appropriées d'analyses techniques lors de l'assemblage d'un ensemble de données à l'appui d'une demande.
Le processus de fabrication doit assurer le maintien d'une souche pure et génétiquement stable ainsi que la production d'un produit uniforme et non contaminé.
Les propriétés toxicologiques et physico-chimiques du produit microbien doivent être bien caractérisées puisque la préparation microbienne pourrait être composée de composés très purifiés tout comme de produits de fermentation bruts, contenant des résidus de milieux, de composés cellulaires et de divers produits et sous-produits de métabolismes microbiens.
Des études sur la toxicité et des essais de génotoxicité pourraient être nécessaires afin de confirmer l'absence de substances nocives qui pourraient être produites comme co-produits au cours du processus de fermentation ou qui pourraient être présentes en tant que contaminants.
Dans les cas où le produit alimentaire pour animaux d'origine microbienne est composé ou est dérivé de microorganismes génétiquement modifiés, d'autres points à considérer comprendraient : l'innocuité de l'organisme donneur (le cas échéant); la caractérisation des modifications génétiques et du caractère nouveau; les propriétés de l'organisme modifié; tous les effets non désirés et les effets secondaires; et la perturbation ou l'altération des voies métaboliques causée par les modifications génétiques. Ces altérations pourraient être avantageuses pour les aliments, pourraient être sans effets ou pourraient introduire des composés toxiques ou allergènes ou même des modifications aux caractéristiques d'innocuité des aliments. Pour un microorganisme vivant, il est nécessaire d'évaluer les propriétés conférées par les modifications génétiques et aussi de déterminer les effets de ces propriétés sur la survie, la compétitivité et l'aptitude de survie du microorganisme dans le tube digestif et dans l'environnement.
2.1 Description et utilisation du produit
Les listes suivantes énumèrent les critères considérés au cours du processus d'évaluation et ont pour objectif de fournir de l'orientation dans la préparation d'une demande d'autorisation. Veuillez soumettre tous les renseignements applicables :
- L'identité du produit et une description, comprenant :
- les noms suggérés
- le type de produit et l'identité de l'ingrédient actif
- la formule du produit; si le produit consiste d'un mélange, inclure aussi la liste des ingrédients et de leur proportion par poids
- l'état physique du produit, y compris tous les processus comme la granulation ou l'encapsulation
- l'objectif du produit ou de l'ingrédient actif
- les modes d'action de l'ingrédient actif
- l'identité taxonomique du microorganisme de production, y compris le numéro de la souche
- Le nombre d'unités et la taille de l'ensemble
- L'étiquette de produit
- Le mode d'emploi d'utilisation, y compris :
- les renseignements concernant le mélange, si utilisé avec d'autres produits
- les proportions, la synchronisation et les intervalles d'alimentation suggérées
- l'identification des espèces pour lesquelles l'utilisation est prévue
- les renseignements sur la distribution, l'entreposage et la manipulation
- les stratégies pour la réutilisation, la revente et l'élimination des produits non utilisés
- Les avis et les approbations réglementaires d'autres organismes gouvernementaux et internationaux.
- Une liste de tous les ingrédients, y compris ceux utilisés dans la fabrication, et une description de leur mode d'action ou de leur objectif.
- La fiche signalétique (FS) du produit et des ingrédients.
- Une description détaillée du processus de fabrication, y compris :
- un ordinogramme du processus de fabrication, de la réactivation des souches à l'emballage du produit, décrivant les étapes de préparation du produit microbien
- la composition du milieu de culture, des premières étapes d'inoculation jusqu'au bioréacteur à capacité de production
- les conditions de la fermentation
- une description détaillée des étapes de séparation et de purification, y compris tous les auxiliaires technologiques qui ont été utilisés au cours du processus de fabrication
- la variation de la concentration de l'ingrédient actif et des impuretés entre les lots
- les procédures de contrôle d'assurance de la qualité et les protocoles de pureté des microorganismes de production avant et au cours de la fabrication, les paramètres de production, la contamination, l'uniformité et la conformité du produit final ainsi que les méthodes utilisées pour surveiller la dérive génétique de l'organisme de production
- les méthodes de traitement et d'élimination des sous-produits et des déchets résultant du processus de fermentation. Les données appuyant l'efficacité du traitement ou les méthodes d'élimination devraient être fournies. Cette exigence est particulière aux fermentations microbiennes effectuées au Canada
- un énoncé confirmant l'application des Lignes directrices canadiennes sur la biosécurité pour utilisation en laboratoire et des Good Large Scale Practices (GLSP) des National Institutes of Health (NIH) pour la fabrication à grande échelle, le cas échéant. Une description devrait être fournie de comment l'installation respecte tous les points décrits dans les Normes et lignes directrices canadiennes sur la biosécurité (NLDCB) ou par les NIH afin d'assurer des méthodes de confinement adéquates
- La composition du produit final, y compris :
- la proportion et la concentration des ingrédients utilisés pour formuler le produit final, y compris la quantité de matériel source dérivé du processus de fermentation (Par exemple, 90% écorce de riz [support] et 10% de fermentât)
- le pourcentage de pureté du matériel source dérivé du processus de fermentation (Par exemple, le fermentât est composé de 70% d'ingrédient actif et de 30% de résidus de milieu). La pureté des autres ingrédients figurant dans le produit doit aussi être fournie
- la quantité d'ingrédients actifs dans le produit final en parties par million (ppm), en pourcentage, en unités formatrices de colonies par gramme (UFC/g) ou en cellules viables par gramme (selon la méthode d'énumération) lorsque l'ingrédient actif est un organisme vivant. Lorsque le produit est composé d'un mélange de microorganismes, chaque souche doit être décrite séparément et les dénombrements pour chacune des souches se trouvant dans le produit doivent être fournis
- l'identification de toutes les matières étrangères probables de se retrouver dans le produit final
- Des certificats d'analyse de trois lots de production ou de lots à l'échelle préindustrielle pour l'ingrédient actif afin d'en démontrer l'identité et la concentration. Des mesures de contrôle ou des normes adéquates doivent être incluses, le cas échéant. Les méthodes d'analyse doivent être décrites ou un renvoi doit leur être effectué dans le cas d'une publication. Par exemple, pour un acide aminé, les données devraient démontrer les concentrations et l'identité de l'acide aminé comparativement à un mélange de normes d'acides aminés.
- Des données à l'appui de la présence ou de l'absence, de la viabilité ou non-viabilité de la souche de production présente dans le produit final, selon la nature et les particularités du produit.
- Des données à l'appui d'une durée de conservation d'au moins 12 mois à compter de la date de fabrication, comme démontré pour au moins 3 lots de production du produit.
- Une liste de tous les métaux lourds, des contaminants chimiques et biologiques, qui sont présents soit de façon intrinsèque ou par introduction par l'entremise du processus, y compris :
- des certificats d'analyse pour la présence de contaminants biologiques pour trois lots de production comprenant la numération totale sur plaque, les espèces de Pseudomonas, la bactérie Salmonella, la bactérie Staphylococcus, l'E. coli, les coliformes, les levures et les moisissures (sans détection de la présence d'Aspergillus flavus ou de Fusarium spp.)
- des certificats d'analyse pour la présence de métaux lourds, de produits chimiques et de mycotoxines, si nécessaire
- les méthodes d'analyse utilisées pour quantifier les contaminants
2.2 Caractérisation du microorganisme de production
Les renseignements suivants doivent être fournis :
- La classification taxonomique selon une nomenclature reconnue, ou auxquelles on fait renvoi dans des documents scientifiques, afin de rendre possible l'identification entière du microorganisme, y compris des éléments suivants : le genre, l'espèce, la sous-espèce, la souche ou le type ainsi que toutes modifications corroborées de la classification et les codes numériques d'identification internes, le cas échéant. Des renseignements sur les méthodes utilisées pour corroborer l'identification ainsi que toutes les données d'essais devraient être fournis (des explications détaillées se trouvent dans le paragraphe D ci-dessous). Un certificat d'analyse devrait être compris, confirmant l'identification des microorganismes provenant de trois lots de production récents.
- Les noms communs, y compris les abréviations et acronymes ainsi que les noms utilisés dans d'autres pays.
- Les numéros d'enregistrement ou tout autre renseignement provenant d'un dépôt de cultures reconnu, si disponible, et un exemplaire du certificat de dépôt de l'organisme (et de la souche parentale si l'organisme de production a été génétiquement modifié).
- Les critères, la méthodologie et les données analytiques afin de corroborer l'identification et l'attribution taxonomique du microorganisme, y compris les traits phénotypiques (morphologie, utilisation de substrat, produits de fermentation, etc.) et l'analyse phylogénique (séquençage d'ARN ribosomal 16S ou 23S ou autre méthode de taxonomie moléculaire). Des essais immunologiques (Par exemple, radio-immuno-essai [RIA]) pourraient être nécessaires selon la source du microorganisme. Pour les cultures pures, les renseignements soumis devraient suffire afin de distinguer le microorganisme de microorganismes semblables et pour décrire sa relation aux pathogènes. Pour les cultures mélangées, il est nécessaire de fournir les renseignements sur l'identification et la caractérisation de chacune des souches présentes dans le mélange ainsi que des méthodes et des critères utilisés pour énumérer chacune d'entre elles. Dans le cas de circonstances exceptionnelles, des mélanges complexes pourraient être considérés au cas par cas.
- L'origine et l'historique de suivi de la souche, de son point d'isolement à son acquisition (Par exemple, habitat original, isolat environnemental, certificat d'origine, isolat clinique, culture de collection) ainsi que son développement (Par exemple, procédures de sélection, maintien de la culture).
- Rapports et documents concernant tout historique d'utilisation ou dangers associés à la souche dans les domaines de l'agriculture, de la production alimentaire et d'autres pratiques industrielles.
- D'autres utilisations enregistrées de la souche et des souches ou espèces très apparentées ainsi que des renseignements sur les voies d'exposition.
- Tous rapports de maladie, de pathogénicité opportuniste, de facteurs de virulence ou de production de toxines associés à la souche ou à des espèces étroitement apparentées. Lorsque des souches ou des espèces de microorganismes apparentées sont capables de causer des effets néfastes, l'absence de tels effets devrait être démontrée dans l'organisme de production : ceci pourrait comprendre des données pour démontrer que les gènes responsables des effets néfastes dans les espèces apparentées ont été identifiés et qu'il est démontré que leur absence ou leur suppression dans la souche de production a été effectuée.
- Description détaillée de toute activité antimicrobienne intrinsèque.
- Descriptions détaillées de tous les facteurs intrinsèques de résistance antimicrobienne présents dans la souche et, lorsque nécessaire, la caractérisation des facteurs de détermination génétique de la résistance antimicrobienne (c.-à-d., si cette résistance est associée à des éléments génétiques mobiles ou si elle est intégrée de façon stable dans le chromosome). Des justifications scientifiques, accompagnées de preuves à l'appui, doivent être fournies concernant les préoccupations en matière d'innocuité, ou l'absence de telles préoccupations, des éléments de résistance présents dans la souche.
Si la présence de résistance aux agents antimicrobiens est détectée, les répercussions potentielles sur la santé des humains et des animaux doivent être décrites. Un examen de la documentation scientifique devrait être effectué afin de documenter toutes les instances de résistance dans d'autres souches de la même espèce contre les médicaments antibiotiques ciblés.
Une norme nationale devrait être respectée (Par exemple, l'Autorité européenne de sécurité des aliments) lors de l'établissement des valeurs des concentrations minimales inhibitrices (CMI) de la souche déclarée. Des souches témoins devraient être comprises avec les valeurs de CMI moyennes pour les espèces et les membres pathogéniques du genre.
- Les renseignements concernant la présence d'éléments génétiques mobiles (Par exemple, séquences d'insertion, transposons, plasmides, prophages).
- Si l'organisme n'a pas été génétiquement modifié, un énoncé à cet effet doit être soumis.
2.3 Développement du microorganisme modifié
Cette sous-section doit seulement être prise en considération si l'organisme a été génétiquement modifié à l'aide de techniques d'acide nucléique recombinant; par la délétion, la réorganisation ou la suppression d'ADN natif; par des techniques de mutagenèse classiques; par pression sélective; ou à l'aide d'autres techniques.
Des renseignements suffisants concernant le processus utilisé afin d'affecter les modifications génétiques devraient être soumis afin de permettre la caractérisation du microorganisme modifié et d'en permettre la comparaison aux homologues conventionnels ou non modifiés. L'identification de tout le matériel génétique introduit, modifié ou supprimé dans l'organisme récipient et l'analyse des données à l'appui de la caractérisation moléculaire devraient permettre d'évaluer l'innocuité ainsi que les effets secondaires et non désirés. Ces effets pourraient être causés par l'activation ou la désactivation de gènes par insertion, la transcription de séquences de vecteur ou les répercussions causées par des produits génétiques étrangers sur le métabolisme de l'hôte, entraînant des niveaux modifiés de produits génétiques ou de métabolites existants.
Le matériel génétique nouvellement exprimé, causé par le matériel génétique introduit ou par le matériel natif modifié, devrait être entièrement caractérisé et les similitudes aux produits provenant de sources traditionnelles devraient être décrites lorsque cela est approprié. Si de nouveaux composants (autres que ceux résultant de modifications volontaires de matériel génétique) sont identifiés, des études plus approfondies seront nécessaires afin de caractériser les effets non désirés ainsi que leur impact sur l'innocuité de l'organisme de production et du produit microbien. Il devrait être démontré que les modifications introduites ne causent aucun effet néfaste, que les modifications sont stables et que la possibilité de transfert de matériel génétique à d'autres espèces n'a pas été augmentée. Bien que les modifications génétiques altèrent l'expression des métabolites ou des composants traditionnels, des renseignements suffisants concernant les voies anaboliques ou cataboliques devraient être fournis afin de permettre l'évaluation des effets secondaires sur les voies connexes et la production de métabolites.
Les renseignements suivants doivent être fournis:
- Description des organismes donneurs et des organismes intermédiaires (le cas échéant), y compris :
- les noms taxonomiques, selon l'organisme de nomenclature le plus reconnu actuellement, ou dont on fait renvoi dans des documents scientifiques, afin de permettre l'identification entière du microorganisme donneur, y compris de tous changements corroborés de la nomenclature et des nomenclatures précédentes
- les noms communs, y compris les abréviations et acronymes ainsi que les noms utilisés dans d'autres pays
- les numéros d'enregistrement ou tout autre renseignement provenant d'un dépôt de cultures reconnu, le cas échéant, et un exemplaire du certificat de dépôt
- les critères et la méthodologie utilisés pour corroborer l'identification et la classification
- l'origine des organismes donneurs et des organismes intermédiaires, y compris l'historique de développement (Par exemple, procédures de sélection, maintien de la culture)
- des rapports et de la documentation concernant toutes les utilisations présentes et précédentes de l'organisme donneur ou des organismes étroitement apparentés dans les aliments pour animaux, les aliments ou d'autres applications, ainsi que des renseignements sur les voies d'exposition et les dangers
- tous rapports de maladie, de pathogénicité opportuniste ou non, de facteurs de virulence ou de production de toxines par l'organisme donneur ou par des organismes étroitement apparentés
- Description et caractérisation des modifications génétiques, y compris :
- la description des modifications génétiques, y compris une liste des gènes introduits, modifiés ou supprimés, leurs fonctions et les caractères nouveaux en résultant
- l'objectif des modifications et les propriétés souhaitées conférées ou les propriétés perdues du microorganisme génétiquement modifié en raison des modifications
- une description détaillée du processus de construction ou de modification de la souche réceptrice, y compris :
- a) un ordinogramme indiquant les noms de l'ADN donneur, récepteur et vecteur et les étapes (liées en ordre de leur développement) utilisées pour construire le microorganisme modifié final
- b) une description des méthodes utilisées pour introduire, supprimer, ou modifier le matériel génétique ainsi que les caractères nouveaux qui en résultent, y compris les renvois et les citations qui les mentionnent
- c) lorsque des vecteurs sont utilisés au cours des modifications génétiques, les renseignements suivants doivent être fournis :
- le nom et la source des vecteurs
- l'origine et la caractérisation des séquences des vecteurs, y compris les éléments réglementaires (Par exemple, les promoteurs, les modificateurs, les amplificateurs, les peptides signaux et les terminateurs), les réplicons, les gènes marqueurs sélectifs et toute instance d'ADN étranger, dans les cas où les vecteurs ou les séquences d'ADN des vecteurs font partie du microorganisme génétiquement modifié. Des citations ou des références devraient être comprises concernant le développement du vecteur
- la pathogénicité et l'infectiosité naturelles du vecteur
- la méthode utilisée pour désamorcer le vecteur, comme l'élimination des marqueurs de résistance antimicrobienne ou l'inactivation des transposons ou d'autres éléments mobiles, le cas échéant
- d) une description des organismes récepteurs intermédiaires utilisés pour produire ou transformer l'ADN avant son introduction dans l'organisme récepteur final
- e) une carte de restriction de chacune des constructions génétiques, indiquant la taille et les positions de toutes les séquences codantes et non codantes, tous les éléments réglementaires, toutes les origines des répétitions et des transferts, tous les marqueurs génétiques, tous les emplacements des sites de restriction, toutes les amorces utilisées pour les analyses PCR et toutes les régions utilisées comme sonde. Un tableau identifiant et effectuant un renvoi à chacune des composantes devrait être compris avec le diagramme. L'annexe III est fournie comme modèle à suivre pour la soumission de données de caractérisation des vecteurs
- 2) La caractérisation de matériel génétique inséré, supprimé ou autrement modifié dans l'organisme récepteur final, comme suit :
- a) l'identification des sites d'insertion, de suppression ou de modification;
- b) la séquence entière du matériel génétique inséré ou modifié;
- c) la taille, l'identité et le nombre de copies du matériel génétique inséré à chacun des sites;
- d) l'organisation et l'orientation du matériel génétique modifié à chacun des sites d'insertion ou de modification;
- e) pour chacune des régions codantes, une démonstration afin de voir si des copies entières ou partielles ont été insérées dans le génome et des données pour démontrer que les promoteurs, les séquences de tête, les terminateurs et les autres régions régulatrices sont insérés de façon intacte avec les régions codantes pour lesquelles ils ont été conçus à en réguler l'expression
- f) l'identification de tous les cadres de lecture ouverts (ORF) au sein du matériel inséré ou créé par les insertions effectuées à l'aide d'ADN chromosomique contigu ou plasmidique, y compris tous ceux qui pourraient donner lieu à des protéines chimères. Lorsque la transcription de tels ORF survient, l'innocuité des protéines chimères et ses effets sur la salubrité du produit doivent être évalués
- g) systèmes de gènes marqueurs : si le système de transfert de gènes se sert d'un gène marqueur qui est exprimé, des renseignements à l'appui de l'innocuité du système de gène marqueur doivent être fournis
- h) la stabilité des modifications génétiques et l'organisation du matériel génétique dans l'organisme récepteur, générés à compter de la fermentation à l'échelle de production ou de projet pilote pour au moins trois répétitions. Les images des électrophorèses sur gel devraient être fournies, démontrant ainsi la stabilité des modifications sur de nombreuses générations
2.4 Caractérisation des caractères nouveaux
Fournir les renseignements suivants concernant les nouvelles modifications, si elles ont été introduites ou si elles sont du matériel génétique natif modifié :
- une description des caractéristiques morphologiques et physiologiques, des tendances de croissance et des taux de croissance du microorganisme modifié comparativement aux souches parentales non modifiées (ou isogéniques)
- des données démontrant la stabilité génétique des organismes modifiés et indiquant que tous les caractères nouveaux sont exprimés et hérités de façon stable
- les produits génétiques, les produits de dégradation, les sous-produits et leurs voies métaboliques et l'analyse des transcriptions ou des produits d'expression pour identifier toutes les nouvelles substances qui pourraient être produites
- les fonctions des produits génétiques
- les descriptions phénotypiques des caractères nouveaux
- les niveaux et les sites d'expression des produits génétiques, y compris ceux des gènes marqueurs, le cas échéant
- la détermination que l'expression du gène est constitutive ou inductible, accompagnée d'une description des agents d'induction
- l'activité des produits génétiques, des produits de dégradation et des sous-produits dans le microorganisme hôte et tous les changements aux voies métaboliques existantes en résultant (y compris le mode d'accumulation et de stockage des matières de réserve)
- pour les microorganismes utilisés dans la transformation ou le traitement d'aliments pour animaux (Par exemple, inoculants pour plantes fourragères, acidifiants), l'activité des produits génétiques, des produits de dégradation et des sous-produits devraient être examinée dans le cadre des conditions d'utilisation
- pour toutes les régions codantes insérées ou modifiées, fournir les données de caractérisation des protéines exprimées, y compris :
- toutes les modifications aux séquences d'acides aminés et aux propriétés des protéines ou les modifications après la transposition aux protéines exprimées, comme la glycosylation ou la phosphorylation, qui pourraient s'être produites lorsque la séquence codante a été modifiée ou transférée d'un organisme à un autre
- dans les cas où la structure des protéines a été modifiée, fournir des données pour démontrer comment les modifications aux acides aminés affectent les sites essentiels à la structure ou à la fonction et les effets de l'homologie des séquences d'acides aminés des nouvelles protéines sur les séquences d'acides aminés de protéines étroitement apparentées de la même famille et sur les protéines natives, en indiquant les emplacements des différences entre les acides aminés et si elles surviennent dans des régions variables ou conservées
- les données suivantes pourraient être nécessaires pour les nouveaux enzymes :
- a) le nom chimique, le numéro de classification de la commission des enzymes et le numéro de registre attribué par le Chemical Abstracts Service (CAS)
- b) une description des fonctions catalytiques et du mode d'action
- c) la spécificité du substrat pour chacune des fonctions catalytiques
- d) les cofacteurs connus nécessaires pour l'activité enzymatique
- e) le pH optimal et le profil de pH
- f) la température optimale et le profil de température
- g) les propriétés cinétiques de chacun des substrats analysés, y compris les valeurs de Vmax, de Km et de Kcat. Lorsque les propriétés catalytiques d'un nouvel enzyme diffèrent des propriétés d'un enzyme natif, une interprétation scientifique valide doit être fournie qui explique l'importance de cette différence d'activité selon la variation de l'étendue d'activité démontrée par les enzymes appartenant à la même famille
- h) pour les enzymes modifiés sur le plan structurel, les effets de la modification sur l'activité du nouvel enzyme, comparativement à l'enzyme natif, dans une étendue de pH, de température et d'autres caractéristiques qui pourraient affecter l'activité de l'enzyme sous les conditions d'utilisation
- i) la stabilité et le devenir métabolique du nouvel enzyme
3 Inactivation des agents antimicrobiens dans les aliments pour animaux
Les agents antimicrobiens sont régulièrement mélangés à des aliments pour le bétail. Le potentiel d'inactivation au cours de l'entreposage dans un aliment mélangé causé par la résistance antimicrobienne intrinsèque, acquise ou incorporée devrait être déterminé. L'efficacité antimicrobienne, en présence de l'agent antimicrobien, devrait être surveillée sur une période raisonnable. Si des paramètres biochimiques, comme le pH ou le taux d'humidité, de l'aliment empêchent l'expression ou l'activité des protéines de résistance antimicrobienne, cette étude pourrait être délaissée.
4 Innocuité humaine et animale
Des renseignements sur l'innocuité doivent être fournis afin de déterminer le type et la sévérité des risques potentiels à la santé des humains et des animaux que pourraient poser les microorganismes ou les produits. Lorsqu'aucune déclaration d'effet néfaste n'est retrouvée, veuillez décrire les étapes que vous avez entreprises afin de déterminer l'absence de rapports à cet effet (Par exemple, les bases de données recherchées, les périodes identifiées dans vos paramètres de recherche, les stratégies de recherche et les mots-clés utilisés). Les renseignements peuvent inclure, sans toutefois s'y limiter, les éléments suivants :
- Les relations à tous les microorganismes associés à des effets indésirables
Veuillez décrire toutes les relations du microorganisme à d'autres microorganismes infectieux, toxiques, pathogéniques ou virulents. Si le microorganisme s'apparente sur le plan taxonomique à des organismes pathogènes, des données doivent être fournies démontrant l'absence de potentiel pathogénique dans le microorganisme en question, y compris l'absence de gènes associés à des effets pathogéniques. - Effets néfastes potentiels sur la santé
Il est nécessaire de déterminer la capacité du nouvel aliment pour animaux de causer des maladies chez les humains et les animaux. Les paramètres d'évaluation comprennent la nature et le degré d'infectiosité, de toxicité et de pathogénicité du nouvel aliment pour animaux. Déclarez tous les facteurs qui pourraient prédisposer un animal à l'effet néfaste, fournissez toutes les données épidémiologiques disponibles et fournissez tous les renseignements sur les événements de pathogénicité opportuniste. - Potentiel de toxicité
Les toxines potentielles produites par les microorganismes et tous les métabolites qui sont associés aux toxines produites par d'autres microorganismes doivent être identifiées et leur pertinence doit être évaluée. Le devenir et les concentrations de ces toxines dans le produit final doivent être déterminés et des études de toxicité pourraient être nécessaires. Dans des cas où une modification génétique entraîne la production de nouvelles substances (c.-à-d., des protéines) ou la modification de substances existantes, des données doivent être soumises pour appuyer l'innocuité des nouvelles substances ou des substances modifiées. La toxicité potentielle de nouvelles substances protéiques peut être évaluée en comparant les séquences d'acides aminés de la nouvelle protéine à celles de toxines connues et en évaluant la stabilité lors de l'exposition à la chaleur et contre la dégradation dans des modèles gastriques et intestinaux adéquats. - Potentiel d'allergénicité
Il est nécessaire d'évaluer le potentiel d'allergénicité de nouvelles protéines envers les animaux et les humains. Actuellement, il n'existe aucun modèle animal fiable ou d'analyses donnant des résultats définitifs pour prédire l'allergénicité. Nous recommandons aux demandeurs de suivre l'approche graduelle cas par cas créée par la FAO et l'OMS et qui est approuvée par le. Pour de l'orientation sur la façon de procéder, veuillez consulter l'ébauche des lignes directrices afin de mener une évaluation de l'innocuité des aliments produits à l'aide de microorganismes à ADN recombinant.Les facteurs à considérer dans l'évaluation du potentiel d'allergénicité comprennent l'organisme de production, l'organisme donneur, le degré de ressemblance des acides aminés entre une nouvelle protéine et les allergènes connus, la sensibilité des nouvelles protéines à la dégradation, sa résistance à la chaleur et les acides ainsi que son degré de réactivité à l'IgE du sérum sanguin d'individus sensibles
- Potentiel de transfert de matériel génétique
Il est nécessaire d'évaluer le potentiel de transfert d'ADN à l'aide d'éléments génétiques transmissibles (Par exemple, plasmides ou transposons de conjugaison) aux microorganismes du tube digestif. Pour les produits microbiens comme les enzymes, les acides aminés et les vitamines, la présence de matériel génétique dans le produit final doit être évaluée et l'importance de ce matériel devrait être évaluée - Potentiel de persistance dans le tube digestif
Pour les produits microbiens vivants, il est recommandé d'évaluer la capacité de survie du microorganisme lors du passage dans le tube digestif, sa persistance dans le tube digestif et ses effets potentiels sur la flore gastro-intestinale - Études sur les animaux
Des études menées sur des animaux en laboratoire ou des essais d'alimentation du bétail pourraient être nécessaires afin de répondre à toutes les préoccupations en matière de toxicologie qui pourraient survenir d'une évaluation de toutes les données soumises. Les épreuves toxicologiques suivantes sont recommandées, au strict minimum, pour chacun des nouveaux aliments de sources microbiennes :- a) Microorganismes viables
- toxicité et infectiosité orale aiguës
- toxicité et infectiosité pulmonaire aiguës
- toxicité cutanée aiguë
- mutagénicité (Par exemple, génotoxicité, mutation ponctuelle, aberration chromosomique, réparation d'ADN avec ou sans activation métabolique)
- toxicité à court terme (c.-à-d., essais de 30 à 90 jours)
- b) Produits de fermentation
- toxicité et infectiosité orale aiguës
- toxicité cutanée aiguë
- mutagénicité (Par exemple, génotoxicité, mutation ponctuelle, aberration chromosomique, réparation de l'ADN avec ou sans activation métabolique)
- toxicité à court terme (Par exemple, essais de90 jours)
D'autres épreuves pourraient être nécessaires selon les résultats d'évaluation de ces études. Des justifications scientifiques appropriées devraient être fournies pour toutes les études qui ont été omises. Veuillez consulter l'annexe I pour une description détaillée de chacune des études.
- a) Microorganismes viables
- Potentiel d'exposition des humains
Des études pourraient être nécessaires afin de pouvoir estimer le potentiel d'exposition des humains. L'évaluation du potentiel d'exposition doit comprendre les microorganismes, les produits génétiques, les produits de dégradation et les autres produits associés. Ces évaluations devraient fournir des renseignements sur les niveaux d'exposition et les voies d'exposition les plus probables. Veuillez prendre en considération la quantité de produits manipulés par les travailleurs, la fréquence et la durée des expositions, les facteurs de dilution et l'utilisation d'équipement de protection puisque ces facteurs pourraient atténuer certains des paramètres d'exposition.
5 Sécurité environnementale
Cette partie des lignes directrices indique les exigences concernant la caractérisation biologique et écologique du nouvel aliment pour animaux. Les renseignements devraient fournir suffisamment de données afin d'évaluer les effets environnementaux potentiels, y compris le sort environnemental des microorganismes, de ses métabolites, de ses produits de dégradation et de tous ses sous-produits. L'objectif est de déterminer et d'évaluer l'étendue de tous les dangers potentiels, c.-à-d. la présence à court et à long terme du nouvel aliment dans l'environnement. Si les facteurs qui contrôlent la survie et la multiplication des microorganismes sont connus, il est plus facile de prédire le degré de survie et de multiplication de l'organisme dans ses conditions d'utilisation. Dans les cas où aucun effet néfaste n'est découvert, veuillez indiquer les raisons pour les possibilités de résultats faussement négatifs ou pour le manque d'information, y compris le manque de recherches publiées, les limites des bases de données dans lesquelles vous avez effectué vos recherches et les limites des paramètres de recherche, y compris l'étendue des périodes, la stratégie de recherche et les mots-clés utilisés. Les résultats doivent être interprétés selon un raisonnement scientifique valide. Les renseignements devraient comprendre ce qui suit, sans toutefois s'y limiter :
- Exigences et caractéristiques des cultures
Veuillez décrire les conditions de culture pertinentes et les propriétés physiologiques affectant la persistance, la prolifération et la croissance du microorganisme. Ces conditions pourraient comprendre des traits comme la température, le pH, l'humidité du substrat, la dépendance nutritionnelle, les exigences en oxygène, les sources d'énergie et la sensibilité ou la tolérance aux agents antimicrobiens, aux produits désinfectants et aux antiseptiques. La sensibilité aux facteurs environnementaux (Par exemple, la lumière du soleil, le taux d'humidité) devrait aussi être considérée. Cette section devrait aussi comprendre une discussion sur les possibilités de réversion du microorganisme modifié à un type sauvage - Cycle de vie
Veuillez décrire les diverses formes du microorganisme au cours de son cycle de vie. Ces renseignements sont importants puisque ces formes peuvent différer en ce qui concerne la persistance, la prolifération ou la dispersion. Ceci pourrait comprendre des formes symbiotiques, des formes viables qui ne peuvent être cultivées, des stades de dormance, des stades de production de spores, etc. - Distribution géographique et degré d'occurrence
Veuillez décrire les autres habitats au Canada où l'on peut retrouver le microorganisme. Les niveaux naturels de microorganismes dans ces habitats ainsi que le décalage de la structure ou de la fonction de la communauté microbienne devraient être pris en considération. Dans le cas particulier de microorganismes génétiquement modifiés, tous les nouveaux habitats qui seraient favorables à la prolifération ou à la dissémination du microorganisme modifié doivent être identifiés - Gamme d'hôtes
Veuillez décrire la spécificité d'hôte. Toutes les autres espèces non ciblées (soit des végétaux, des invertébrés ou des vertébrés, selon l'objectif du produit) qui pourraient être affectées par le nouvel aliment pour animaux doivent être examinées. - Mode d'action
Veuillez décrire de quelle façon le microorganisme exerce ses effets sur l'espèce ciblée si ces renseignements sont connus - Effets néfastes potentiels sur la santé
Il est nécessaire d'évaluer la capacité du nouvel aliment de causer des effets néfastes sur la santé de végétaux, d'animaux et de microorganismes non ciblés. Des exemples d'espèces indicatrices non ciblées appropriées peuvent être retrouvés dans les lignes directrices d'Environnement et Changement climatique Canada et de la United States Environmental Protection Agency. Les paramètres comprendront la nature et le degré d'infectiosité, de toxicité et de pathogénicité du nouvel aliment pour animaux. Veuillez déclarer tous les facteurs associés à l'effet ainsi que toutes les données épidémiologiques disponibles - Production de toxines
Toutes les toxines produites par le nouvel aliment pour animaux ainsi que tous les métabolites qui s'apparentent à des toxines produites par d'autres microorganismes doivent être identifiées et leur pertinence doit être évaluée. Leur sort et leur concentration dans le produit final doivent aussi être déterminés - Potentiel de transfert de matériel génétique
Il est nécessaire d'évaluer le degré de transfert de matériel génétique dans l'environnement (c.-à-d., aux microorganismes du sol, à la faune, etc.) par des plasmides ou des transposons de conjugaison - Diversité biologique
Il est nécessaire d'évaluer les effets du nouvel aliment pour animaux sur la diversité biologique (Par exemple, la distance séparant les sites d'utilisation de lieux peuplés ou protégés; l'identification et les effets sur les espèces en péril ou menacées; ou toutes les ressources biologiques d'importance sociale ou économique se trouvant dans la région du lieu d'utilisation prévue)
6 Décision réglementaire
Selon les renseignements reçus et après avoir évalué les effets potentiels du nouvel aliment sur le bétail, les humains et l'environnement, la DAA :
- autorisera la mise en marché du nouvel aliment pour animaux dans les cas où les risques sont minimes (des conditions pourraient être imposées sur les autorisations relativement à la gestion des risques)
- refusera d'autoriser la mise en marché du nouvel aliment pour animaux lorsque son utilisation pose un risque inacceptable
- effectuera un suivi auprès du demandeur (en envoyant un document connu sous le nom de « lettre de déficiences ») pour obtenir l'information supplémentaire dont la DAA a besoin afin d'achever l'évaluation. Il se peut que la DAA considère que le dossier est clos si la lettre de déficiences reste sans réponse après 60 jours de la date de son envoi
Lorsqu'un nouvel aliment du bétail, y compris un aliment doté d'un caractère nouveau, est autorisé (c.-à-d. qu'il est mentionné dans l'annexe IV ou V ou que l'on a déterminé qu'il est essentiellement équivalent à un ingrédient déjà mentionné dans les annexes), il n'est plus considéré comme un aliment nouveau
7 Exigences en matière de nouvelle information
Si, à un moment quelconque, le demandeur apprend l'existence de nouveaux renseignements concernant des risques à l'environnement, au bétail ou aux humains qui pourraient découler de la dissémination du nouvel aliment du bétail, celui-ci doit communiquer immédiatement cette information à l'ACIA. Selon cette nouvelle information, peu importe la source, l'ACIA procédera à une réévaluation des risques pour l'environnement et des impacts possibles sur celui-ci, y compris le risque pour la santé humaine ou animale et les impacts possibles sur celles-ci, liés à l'utilisation de l'aliment du bétail. L'ACIA pourrait imposer d'autres conditions relativement à la dissémination ou à l'utilisation de l'aliment du bétail; modifier les conditions se rapportant aux autorisations accordées ou les annuler; exiger du demandeur qu'il cesse toute dissémination ou utilisation de l'aliment du bétail et qu'il prenne les mesures nécessaires pour éliminer ou limiter le risque.
Ces Directives relatives à l'évaluation des nouveaux aliments du bétail : produits d'origine microbienne ont été préparées afin de fournir de l'orientation pour la présentation de demandes d'autorisation de distribution de nouveaux aliments pour animaux, comme pourrait être exigé en vertu du Règlement sur les aliments du bétail. Veuillez noter que les renseignements fournis dans ces lignes directrices ne sont pas exhaustifs et seront mis à jour périodiquement s'il y a lieu afin de représenter les connaissances scientifiques actuelles. Pour plus de détails, les demandeurs sont fortement encouragés à consulter l'ACIA. Aux fins d'interprétation et d'application de la Loi, nous recommandons aux demandeurs de consulter la version officielle des lois et règlements pertinents.
8 Définitions
- Biotechnologie :
- application des sciences et de l'ingénierie à l'utilisation directe ou indirecte d'organismes vivants ou de leurs parties ou produits, sous leur forme naturelle ou modifiée (Loi canadienne sur la protection de l'environnement).
- ADN porteur :
- ADN utilisé pour accélérer la préparation ou l'introduction du matériel génétique dans une plante, mais qui ne fait pas partie de la construction.
- Codex Alimentarius:
- ou « Code alimentaire » (latin) : organisme international créé en 1963 par l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO) et l'Organisation mondiale de la Santé (OMS) pour élaborer des normes, des lignes directrices et des codes d'usages pour les aliments dans le cadre du Programme mixte FAO/OMS sur les normes alimentaires. Les objectifs principaux de ce programme sont la protection de la santé des consommateurs, la promotion de pratiques loyales en matière de commerce de denrées alimentaires et la promotion de la coordination entre tous les travaux d'élaboration de normes alimentaires entrepris par des organisations internationales gouvernementales et non gouvernementales (Codex Alimentarius)
- Région codante :
- Séquence d'ADN qui peut être traduite pour produire une protéine. Cette région est composée du brin codant (brin sens ou brin plus [+]), dont la séquence est complémentaire à celle de l'ARNm, et du brin non codant (brin antisens ou brin négatif [-]), qui est complémentaire au brin codant.
- Construction :
- Fragment d'ADN génétiquement manipulé (Par exemple, plasmide) qui contient, sans y être limité, des séquences d'ADN à intégrer dans le génome de la plante cible.
- Homologue :
- Un aliment du bétail sélectionné par le demandeurauquel on comparera l'aliment nouveau. L'homologue choisi devrait, si c'est possible, être l'équivalent génétique le plus rapproché et peut être un aliment nouveau du bétail déjà évalué et autorisé. Si l'équivalent génétique le plus rapproché n'est pas semblable à l'aliment nouveau, on pourra aussi comparer cet aliment avec les produits qu'il est censé imiter.
- Citations de bases de données :
- Sources d'information publiquement accessible sur les séquences de nucléotides ou de protéines. Voici cinq bases de données couramment utilisées et les adresses de leurs sites Web :
GenBank (anglais seulement) : Collection annotée de toutes les séquences d'ADN publiquement accessibles, conservée par la National Institutes of Health (NIH) – (anglais seulement).
- Banque de données japonaise sur l'ADN (anglais seulement) :
- Banque d'ADN officiellement certifiée du Japon – (anglais seulement), qui recueille des séquences d'ADN des chercheurs.
- Séquences de nucléotides du EMBL – (anglais seulement) :
- Base de données sur des séquences d'ADN et d'ARN prélevées des publications scientifiques, des demandes de brevets et directement présentées par des chercheurs et des groupes de séquençage.
- Banque de données sur les séquences des protéines SWISS-PROT – (anglais seulement) :
- Base de données sur des séquences de protéines produites en collaboration par Amos Bairoch (Université de Genève) et l'EBI.
- Banque de données sur les allergènes du FARRP – (anglais seulement) :
- Banque de données contenant une liste d'allergènes uniques connus et présumés identifiés grâce à des recherches dans les banques de données sur les protéines qui sont publiquement accessibles. Cette base de données est gérée par un groupe de scientifiques et de cliniciens qui participent activement à l'examen des données pour l'inclusion des protéines dans la base de données en comparant les publications évaluées par des pairs appuyant la classification des protéines en tant qu'allergènes ou allergènes présumés selon des critères prédéterminés.
- Drogue :
Comprends les substances ou les mélanges de substances fabriquées, vendues ou présentées comme pouvant servir w:
- au diagnostic, au traitement, à l'atténuation ou à la prévention d'une maladie, d'un trouble, d'un état physique anormal ou de leurs symptômes, chez les êtres humains ou les animaux
- à la restauration, à la correction ou à la modification des fonctions organiques chez les êtres humains ou les animaux
- à la désinfection des locaux où des aliments sont fabriqués, préparés ou gardés (Loi sur les aliments et drogues)
Un aliment pour animaux à valeur nutritionnelle améliorée est considéré comme étant un aliment pour animaux lorsque celui-ci est préparé aux fins de satisfaction de besoins nutritionnels ou de correction de troubles nutritionnels. Un produit nutraceutique ou un aliment fonctionnel possédant des allégations de bienfaits sur la santé peut être considéré comme étant un aliment ou une drogue selon le mode d'action et la nature de l'ingrédient actif. Dans ces cas, le Programme des aliments du bétail évalue les demandes d'enregistrement au cours de l'étape préalable à l'enregistrement et une décision est prise selon les renseignements fournis par le demandeur.
- Environnement :
Ensemble des conditions et des éléments naturels de la Terre, notamment
- air, terre et eau
- toutes les couches de l'atmosphère
- toute matière organique et inorganique ainsi que les organismes vivants;
- les systèmes naturels en interaction qui comprennent les éléments visés aux points a) à c) (Règlement sur les aliments du bétail)
- Familiarité :
- Connaissance des caractéristiques d'un aliment donné et expérience basée sur son utilisation au Canada.
- Aliment du bétail (aliments pour animaux) :
Substances ou mélanges de substances renfermant notamment des acides aminés, des produits antioxydants, des glucides, des condiments, des enzymes, des lipides, des éléments minéraux, des produits azotés non protéiques, des protéines, des vitamines, des liants pour agglomérés, des colorants, des agents moussants ou des aromatisants et toute autre substance fabriquée, vendue ou représentée pour l'utilisation suivante :
- la consommation par des animaux de ferme
- la satisfaction des besoins nutritionnels des animaux de ferme
- la prévention ou la correction des troubles nutritionnels chez les animaux de ferme (Loi relative aux aliments du bétail)
- Modification génétique :
- Toute intervention intentionnelle se traduisant par un changement des caractères héréditaires d'un organisme. Cela comprend, mais non exclusivement, des changements entrainés par les techniques de recombinaison des acides nucléiques, la variation somaclonale, l'électroporation, la mutagenèse provoquée artificiellement et d'autres techniques similaires.
- Microorganismes génétiquement modifiés (OGM) :
- Aux fins de ce document, représente les bactéries, les moisissures et les champignons filamenteux dans lesquels le matériel génétique a été modifié par l'entremise d'une modification génétique.
- Insert :
- Partie d'une construction qui est intégrée au génome de la plante réceptrice.
- Irritant :
- Agent capable de provoquer un état anormal d'excitation ou de sensibilisation dans une partie du corps d'un humain ou d'un animal.
- Animaux de ferme
- (bétail): Les chevaux, les bovins, les moutons, les chèvres, les porcs, les renards, les visons, les poissons, les lapins et la volaille, et incluent d'autres bêtes que la réglementation peut considérer comme du bétail aux termes de la Loi sur les aliments du bétail.
- Microorganismes :
- Généralement considéré comme comprenant les algues, les bactéries, les champignons (levures et moisissures), les protozoaires et les virus.
- Région non codante :
- Séquences d'ADN situées à l'extérieur d'un cadre ouvert de lecture et non traduites pour faire partie d'une protéine. Les régions non codantes peuvent comprendre les régions d'ancrage, « scaffold attachment regions » ou « SAR », des promoteurs, des séquences de tête, des activateurs, des introns, des terminateurs et toute autre séquence utilisée pour l'expression des gènes, soit dans le végétal ou dans d'autres hôtes, comme les origines de réplication, les éléments de transposons, les bordures d'ADN transféré (ADN-T), les séquences lox, etc.
- Aliment nouveau du bétail (nouvel aliment pour animaux/du bétail) :
Aliment constitué d'un ou de plusieurs organismes, de leurs parties ou de leurs produits et qui, selon le cas :
- n'est pas mentionné dans les annexes IV ou V du Règlement sur les aliments du bétail
- présente un caractère nouveau (Règlement sur les aliments du bétail)
Tous les ingrédients d'aliments pour animaux approuvés au Canada figurent dans l'annexe IV ou V du Règlement sur les aliments du bétail. Un aliment qui n'est pas constitué d'un organisme ou de leurs parties et qui ne figurent pas dans l'annexe IV ou V du Règlement sur les aliments du bétail est considéré comme étant un « aliment nouveau » (Par exemple, un ingrédient chimique floculant ou un ingrédient composé de poudre d'écorce) et doit faire l'objet d'évaluations de son innocuité et de son efficacité. Toutefois, un aliment est considéré comme étant un « nouveau produit alimentaire » lorsqu'il est constitué d'un ingrédient approuvé (Par exemple, une source purifiée d'un ingrédient existant). Dans ces cas, une évaluation de l'innocuité pourrait ne pas être nécessaire aux fins de l'approbation de l'aliment. Le Programme des aliments du bétail évalue si un aliment est « nouveau » ou un « nouveau produit alimentaire » selon les renseignements fournis par le demandeur.
- Caractère nouveau :
caractère d'un aliment du bétail qui
- d'une part, a été intentionnellement sélectionné, créé ou incorporé dans celui-ci par une modification génétique particulière
- d'autre part, en ce qui a trait à son usage particulier et à son innocuité tant pour l'environnement que pour la santé humaine et animale, sur la foi d'une justification scientifique valable, n'est essentiellement équivalent à aucun caractère d'un aliment semblable mentionné dans les annexes IV ou V (Règlement sur les aliments du bétail)
- Documents de consensus de l'OCDE :
- Rapports publiés par l'Organisation de coopération et de développement économique (OCDE) qui contiennent des renseignements techniques à utiliser lors de l'évaluation réglementaire de produits biotechnologiques (). Ces documents sont mutuellement reconnus parmi les pays membres de l'OCDE.
- Dissémination :
- Rejet ou émission dans l'environnement d'un aliment ou d'un produit animal produit de celui-ci, ou l'exposition d'un aliment ou d'un produit à l'environnement (Règlement sur les aliments du bétail) (release).
- Stabilité :
- Aptitude du caractère à s'exprimer dans la lignée végétale modifiée et les lignées qui en sont issues, de façon constante, fiable et prévisible.
- Équivalence substantielle :
- Équivalence d'un aliment du bétail dérivé d'un végétal, à l'intérieur d'une espèce végétale donnée, en ce qui a trait à son usage particulier et à son innocuité tant pour l'environnement que pour la santé humaine et animale, aux caractères de la même espèce qui, actuellement et de façon générale, sont considérés comme sans danger au Canada, d'après des bases scientifiques valables.
- Caractère :
- caractéristique ou ensemble de caractéristiques phénotypiques conférées au végétal récepteur par des modifications génétiques précises.
- Effets non intentionnels :
- caractères dont la présence est non intentionnelle et qui sont causés par l'acquisition de caractères supplémentaires ou par la perte ou la modification de caractères existants à la suite de modifications génétiques. Les effets non intentionnels peuvent être bénéfiques, nuisibles ou neutres pour la santé du végétal et l'innocuité pour la santé humaine ou animale.
- Vecteur :
- Molécule d'ADN à réplication autonome dans laquelle on insère de l'ADN étranger et que l'on propage ainsi dans une cellule hôte.
- Produit biologique vétérinaire :
Indique
- un helminthe, un protozoaire ou un microorganisme
- une substance ou un mélange de substances dérivées des animaux, des helminthes, des protozoaires ou des microorganismes
- une substance d'origine synthétique cette substance est fabriquée, vendue ou proposée pour utilisation dans le rétablissement, la correction ou la modification des fonctions organiques des animaux ou dans le diagnostic, le traitement, l'atténuation ou la prévention d'une maladie, d'un trouble ou d'un état physique anormal des animaux, ou de leurs symptômes (Loi sur la santé des animaux)
Les produits biologiques vétérinaires comprennent les vaccins, les vaccins bactériens, les anatoxines bactériennes, les immunoglobulines, les trousses de diagnostic et tous les produits vétérinaires biologiques biotechnologique.
Annexe I : Description des essais de toxicité, d'infectiosité et de pathogénicité
L'objectif de ces épreuves est d'évaluer la capacité des nouveaux aliments pour bétail de provoquer des signes manifestes de toxicité et de causer des maladies et des blessures de tissus par l'envahissement et la multiplication au sein de tissus humains, animaux ou de l'environnement.
1. Essais de toxicité
Les types de données sur la toxicité qui sont généralement pris en considération sont soulignés ci-dessous. Veuillez remarquer que des témoins positifs et des témoins négatifs adéquats sont nécessaires pour mener des essais dans les cas où de tels témoins sont applicables. La meilleure méthode afin d'assurer que les essais sont menés de façon adéquate et utilisent le modèle in vivo ou in vitro approprié est d'assurer qu'ils sont effectués conformément à des méthodes normalisées d'épreuves sur la toxicité, comme publiées par la U.S. Food & Drug Administration, l'Organisation de coopération et de développement économique (OCDE) et l'organisme de normalisation ASTM International.
- Taux et degré d'absorption
Pour chacune des voies par lesquelles une substance peut pénétrer dans le corps (orale, cutanée, respiratoire, etc.), des épreuves d'absorption déterminent l'étendue et la vitesse de l'absorption - Données sur la distribution, le métabolisme et l'élimination
Ces épreuves indiquent le sort du produit chimique après avoir été absorbé dans le corps. Les questions que ces données devraient être en mesure de répondre sont : Où est-il transporté? Est-il accumulé? Comment est-il dégradé ou transformé? Par quelle voie et à quelle vitesse est-il éliminé? Ces renseignements fournissent une indication de la capacité d'un organisme de tolérer des expositions à court ou à long terme et à des concentrations faibles ou élevées. Ces renseignements sont aussi utiles dans la conception d'épreuves de toxicité (Par exemple, épreuves de sélection de la dose). Ils servent aussi à effectuer la transposition de données animales aux humains. - Toxicité aiguë
Des épreuves d'exposition aiguë examinent les effets d'expositions uniques à court terme à des concentrations élevées d'une substance. Les périodes d'exposition lors de ces épreuves sont normalement de 24 heures ou moins et les effets sont surveillées pendant jusqu'à deux semaines. Ces données sont pratiques afin d'établir la relation entre la dose et la réponse, pour classer les substances selon leur niveau de toxicité aiguë relatif, à des fins de classification et afin de composer des énoncés de mise en garde pour étiquettes. Des données de toxicité aiguë sont utilisées afin d'obtenir des renseignements préliminaires sur les effets toxiques particuliers de substances et sur comment ces effets pourraient être causés (mode d'action). Les épreuves spécialisées de toxicité aiguë comprennent :- i) Létalité aiguë médiane
La concentration d'une substance qui, après avoir été administrée une fois à un groupe d'animaux pendant une brève période, cause la mort de la moitié des animaux. Ceci est exprimé comme étant la DL50 (la dose létale en mg/kg de poids corporel) ou la CL50 (la concentration létale en parties par millions [ppm]). Les voies d'exposition proposées sont par voie orale, par voie cutanée et par inhalation. - ii) Irritation de la peau et des yeux
Ceci détermine si une substance a le potentiel de causer une irritation ou la mort cellulaire (nécrose) au contact de la peau ou des yeux.Veuillez remarquer que des épreuves sur les effets sur les yeux et la peau ne sont pas toujours exigées. Veuillez communiquer avec la DAA pour de l'orientation concernant si vous devez effectuer ces épreuves.
- iii) Sensibilisation cutanée
Ceci évalue la propriété de rendre les organismes plus sensibles. Après une exposition initiale, les organismes peuvent devenir plus sensibles à cette substance et des réactions allergiques peuvent se manifester lors des expositions ultérieures.Veuillez remarquer que des épreuves de sensibilisation cutanée ne sont pas toujours exigées. Toutefois, si les données de caractérisation indiquent que le microorganisme s'apparente étroitement à une substance dermatophyte, des essais d'infectiosité cutanée pourraient devenir nécessaires. Veuillez communiquer avec la DAA pour de l'orientation concernant si vous devez effectuer ces épreuves.
- i) Létalité aiguë médiane
- Mutagénicité
Ces épreuves sont des analyses de dépistage permettant de déterminer le potentiel d'une substance d'engendrer des mutations génétiques. Ces mutations du matériel génétique peuvent conduire à l'apparition d'un cancer ou d'une malformation chez la progéniture. Au moins deux types d'essais sont effectués en général, l'un sur des cultures bactériennes et l'autre sur des cultures de cellules mammaliennes. Il est également nécessaire d'effectuer les essais avec et sans activation, c'est-à-dire de déterminer si les interactions avec les processus métaboliques dans l'organisme rendent une substance « mutagène ». - Toxicité à court terme
Les études de toxicité à court terme consistent en une exposition répétée à une substance durant une période plus longue (de 30 à 90 jours). Elles sont utiles pour détecter la majorité des effets nocifs pour la santé à plus long terme, pour établir la dose sans effet observé (DSEO), pour déterminer les effets cumulatifs possibles de l'exposition, de l'espèce et d'autres types de variations, ainsi que pour déterminer les conditions appropriées pour les essais chroniques, s'il y a lieu. On procède en général à une étude de 90 jours par voie orale, mais les études par inhalation ou par voie cutanée sont parfois plus appropriées, selon les conditions d'exposition chez les humains. - Cancérogénicité
Lorsque d'autres données ou des essais antérieurs l'indiquent, on examine la capacité d'une substance d'induire un cancer (des tumeurs) chez les animaux. En général, les essais sont menés sur une longue période de la durée de vie de l'animal, et sont souvent combinés à des essais de toxicité chronique - Études épidémiologiques
Dans ce type d'étude, on compile et on analyse les informations sur les humains qui ont été exposés à une substance, soit par leur travail, soit par accident - Interaction chimique
L'effet toxique d'une substance peut parfois être altéré (accru, diminué ou totalement changé) par son interaction avec d'autres substances. Une toxine peut être inactivée par une autre, ou voir son effet amplifié. Les données visant à identifier et à mesurer l'importance de telles interactions facilitent l'évaluation du danger de la substance en question
2. Infectiosité bactérienne ou virale aiguë
Cette épreuve est effectuée par injection intraveineuse d'un éventail de doses uniques de l'ingrédient actif dans un sujet animal adéquat. Cette étude fournit des renseignements sur les dangers à la santé qui peuvent survenir dans le cas d'une exposition unique à une forte dose lorsque la barrière qu'est la peau est contournée. Les résultats de cette étude sont utiles puisqu'ils servent d'indication de l'infectiosité inhérente d'un organisme. Elles sont le plus souvent seulement utilisées sur des bactéries dont le degré d'infectiosité est inconnu et sur des virus.
3. Infectiosité fongique ou protozoaire aiguë
Cette épreuve est effectuée par injection intrapéritonéale (dans le péritonéum, c.-à-d., la cavité abdominale) d'un éventail de doses unique de l'ingrédient actif dans un sujet animal adéquat. Cette étude fournit des renseignements sur les risques pour la santé susceptibles de résulter d'une seule exposition à forte dose lorsque la peau est contournée en tant que barrière. Les résultats de cette étude sont utiles puisqu'ils servent d'indication de l'infectiosité inhérente d'un organisme. Elles sont le plus souvent utilisées pour les champignons et les protozoaires seulement. Si, selon les caractéristiques physiques du microorganisme, les analyses effectuées par voie intraveineuse sont possibles, la voie intraveineuse devrait donc être considérée pour les champignons et les protozoaires au lieu de la voie intrapéritonéale.
Annexe II : Listes de vérification de données moléculaires
| Liste de vérification | Inclus? |
|---|---|
| Les transferts Northern sont identifiés d'un numéro de figure et d'un titre. | |
| Les couloirs du transfert Northern sont identifiés sur le support. | |
La légende de la figure indique chaque couloir du transfert, y compris une description des éléments suivants concernant l'ARN qui a été déposé :
|
|
| Le texte ou la légende de la figure indique comment l'ARN a été extrait avant l'électrophorèse. | |
| Le transfert possède des couloirs témoins positifs et négatifs adéquats (le témoin positif pourrait démontrer l'hybridation de la sonde avec elle-même et le témoin négatif pourrait être le microorganisme isogénique non modifié). | |
| Le système de gel et le protocole d'hybridation Northern sont décrits dans le texte ou cités dans un renvoi à des documents scientifiques. Toute modification des protocoles cités doit être décrite dans le texte de la présentation. | |
| La position des étalons de taille moléculaire sur le gel est indiquée et ils recouvrent une étendue de taille adéquate pour les fragments qui sont prévus d'être détectés sur le transfert. | |
| La sonde utilisée pour l'hybridation est décrite de façon adéquate (dans le texte ou dans une figure) afin de permettre l'interprétation des résultats. | |
| La méthodologie ou la citation pour l'analyse quantitative (le cas échéant) a été fournie et un nombre suffisant de répétitions ou d'échantillons ont été analysés afin de déterminer s'il existe des différences considérables entre les échantillons ou les traitements. | |
| Tous les couloirs ou les signaux de fond superflus sont expliqués adéquatement. |
| Liste de vérification | Inclus? |
|---|---|
| Les transferts Southern sont identifiés d'un numéro de figure et d'un titre. | |
| Les couloirs du transfert sont identifiés sur le support. | |
La légende de la figure indique chaque couloir du transfert, y compris une description des éléments suivants concernant l'ADN qui a été déposé sur le gel :
|
|
| Le gel possède des couloirs témoin positifs et négatifs adéquats (le témoin positif pourrait démontrer l'hybridation de la sonde avec elle-même et le témoin négatif pourrait être le microorganisme parent isogénique non modifié). | |
| Le système sur gel et le protocole d'hybridation Southern sont décrits dans le texte ou sont cités dans un renvoi à des documents scientifiques et toutes les modifications des protocoles cités sont décrites dans le texte de la soumission. | |
| La position des étalons de taille moléculaire sur le gel est indiquée et ils recouvrent une étendue de taille adéquate pour les fragments qui sont prévus d'être détectés sur le transfert. | |
| Si un plasmide entier a été utilisé comme sonde d'hybridation, il doit être décrit de façon adéquate dans le texte ou dans une figure afin de permettre l'interprétation des résultats. | |
| Si un fragment de restriction a été utilisé comme sonde pour l'hybridation, il doit être décrit de façon adéquate dans le texte ou dans une figure afin de permettre l'interprétation des résultats. | |
| Tous les couloirs ou les signaux de fond superflus sont expliqués adéquatement. |
| Liste de vérification | Inclus? |
|---|---|
| Les analyses d'hybridation sur tache sont identifiées d'un numéro de figure et d'un titre. | |
| Les couloirs des analyses d'hybridation sur tache sont identifiés sur le support. | |
La légende de chacune des figures indique chaque couloir du transfert, y compris une description des éléments suivants concernant l'ARN qui a été déposé :
|
|
| Le texte ou la légende de la figure indique comment l'ARN a été extrait avant le transfert sur le support. | |
| Le transfert possède des couloirs témoin positifs et négatifs adéquats (le témoin positif pourrait démontrer l'hybridation de la sonde avec elle-même et le témoin négatif pourrait être le microorganisme parent isogénique non modifié). | |
| Le système d'hybridation sur tache et les protocoles d'hybridation sont décrits dans le texte ou sont cités dans un renvoi à des documents scientifiques et toutes les modifications des protocoles cités sont décrites dans le texte de la soumission. | |
| La sonde utilisée pour l'hybridation est décrite de façon adéquate (dans le texte ou dans une figure) afin de permettre l'interprétation des résultats. | |
| La méthodologie ou la citation pour l'analyse quantitative (le cas échéant) a été fournie et un nombre suffisant de répétitions ou d'échantillons ont été analysés | |
| afin de déterminer s'il existe des différences considérables entre les échantillons ou les traitements. |
| Liste de vérification | Inclus? |
|---|---|
| Les transferts Western sont identifiés d'un numéro de figure et d'un titre. | |
| Les couloirs de transfert sont identifiés sur le support. | |
La légende de la figure indique chaque couloir du transfert, y compris une description des éléments suivants concernant la protéine qui a été déposée :
|
|
| La méthode d'extraction de la protéine est adéquatement décrite dans le texte ou dans la figure. | |
| Le protocole de préparation de l'anticorps ou de l'antisérum est adéquatement décrit dans le texte, y compris une description adéquate de l'antigène et de sa pureté. La spécificité de l'anticorps et de l'antisérum ont été déterminés et sont décrits dans le texte ou sont cités dans un renvoi à des documents scientifiques. | |
| Le système de gel et le protocole de transfert sont décrits dans le texte ou sont cités dans un renvoi à des documents scientifiques. | |
| La position des étalons de poids moléculaire sur le gel est indiquée et ils recouvrent une étendue de taille adéquate pour les fragments qui sont prévus d'être détectés sur le transfert. | |
| Le transfert possède des couloirs témoins positifs et négatifs adéquats. | |
| Un témoin constitué de sérum normal a été utilisé. | |
| Tous les couloirs ou les signaux de fond superflus sont expliqués adéquatement. | |
| La méthodologie ou la citation pour l'analyse quantitative (le cas échéant) a été fournie et un nombre suffisant de répétitions ou d'échantillons ont été analysés afin de déterminer s'il existe des différences considérables entre les échantillons ou les traitements. |
| Liste de vérification | Inclus? |
|---|---|
| Les gels de PCR sont identifiés d'un numéro de figure et d'un titre. | |
| Les couloirs du gel de PCR sont identifiés. | |
La légende de la figure indique chaque couloir du gel, y compris une description des éléments suivants concernant l'ADN qui a été déposé :
|
|
| La position des étalons de poids moléculaire sur le gel est indiquée et ils recouvrent une étendue de taille adéquate pour les fragments qui sont prévus d'être détectés sur le gel. | |
| Le texte ou la légende de la figure indique la technique d'amplification par la PCR utilisée avant l'électrophorèse. | |
| Les amorces utilisées pour l'amplification sont décrites de façon adéquate dans le texte ou dans une figure afin de permettre l'interprétation des résultats. | |
| Le gel possède des couloirs témoin positifs et négatifs adéquats (pourrait démontrer la spécificité des amorces et la capacité d'amplifier la bande de la taille appropriée; des témoins négatifs pourraient comprendre l'amplification avec un ADN de la lignée ou variété végétale parentale non modifiée, et l'amplification en l'absence de matrice d'ADN). | |
| Le plasmide complet ou le fragment de restriction qui a été utilisé comme matrice témoin positive est décrit de façon claire dans le texte ou dans la légende de la figure afin de permettre l'interprétation des résultats de la PCR. | |
| Le système de gel et le protocole de la PCR sont décrits dans le texte ou sont cités dans un renvoi à des documents scientifiques et toutes les modifications des protocoles cités sont décrites dans le texte. |
| Liste de vérification | Inclus? |
|---|---|
| Le tableau est identifié d'un numéro et d'un titre. | |
| Les entrées sont clairement identifiées dans le tableau et sont décrites dans le texte ou la légende du tableau. | |
| La méthode de préparation de l'échantillon est décrite. | |
| Le protocole de préparation de l'anticorps ou de l'antisérum est adéquatement décrit dans le texte ainsi que les renseignements sur l'antigène et sa pureté. La spécificité de l'anticorps ou de l'antisérum a été démontrée dans le texte ou dans un renvoi à des documents scientifiques. | |
| Le protocole ELISA utilisé est décrit dans le texte ou dans un renvoi à des documents scientifiques et toutes les modifications apportées au protocole utilisé sont indiquées. | |
| Des témoins positifs (Par exemple, protéine purifiée) et négatifs (Par exemple, sérum normal ou préimmun, matériel non transformé) appropriés ont été utilisés. | |
Lorsque la technique ELISA est utilisée pour mesurer quantitativement l'expression d'une protéine dans des microorganismes génétiquement modifiés :
|
| Liste de vérification | Inclus? |
|---|---|
| La figure (ou le tableau) possède un titre et une légende. | |
| Les axes ou les colonnes sont bien identifiés dans les graphiques ou les tableaux et les unités sont aussi indiquées. | |
| L'échelle de la figure représente fidèlement les données et permet de les interpréter. | |
La légende ou le texte indique :
|
|
| Le texte ou la légende décrit l'extraction et la purification de l'enzyme et le degré de purification réalisé. | |
| La méthode d'essai et les renseignements pertinents concernant l'enzyme sont fournis dans le texte ou sont cités dans un renvoi à des documents scientifiques. | |
| L'essai comprend des témoins appropriés. | |
| La stabilité de l'enzyme a été prise en compte dans la conception de l'essai ou dans l'interprétation des données. | |
| La cinétique chimique de l'enzyme a été calculée et, lorsque possible, comparée à des données publiées. | |
| Si une analyse quantitative est effectuée, un nombre suffisant de répétitions ou d'échantillons ont été analysés afin de déterminer s'il existe des différences considérables entre les échantillons ou les traitements et une analyse statistique a été effectuée. |
Annexe III : Description des vecteurs
Ces renseignements sont extraits du document intitulé « Données de la caractérisation moléculaire » qui a été préparé par l'ACIA en collaboration avec Santé Canada et l'USDA-APHIS en 1998. Le document décrit les éléments essentiels à considérer au cours de l'examen de données de la caractérisation moléculaire de végétaux transgéniques. Le même format devrait être respecté pour la présentation de données de la caractérisation moléculaire de produits microbiens.
| Élément génétique |
TailleNote de tableau 1 (Ko) |
Fonction et source |
|---|---|---|
| BD | 0,36 | Fragment de restriction du plasmide pTiT37 contenant les 24 pb de la bordure droite (BD) de l'ADN-T de type nopaline, utilisé pour amorcer le transfert de l'ADN-T de la bactérie Agrobacterium tumefaciens au génome de la plante (Depicker et coll., 1982). |
| E35S | 0,62 | Le promoteur du virus de la mosaïque du chou-fleur (CaMV) (Odell et coll., 1985) avec la région activante dupliquée (Kay et coll., 1987). |
| cryIIIA | 1.8 | Gène qui confère la résistance au doryphore de la pomme de terre (DPT). Le gène code une séquence d'acides aminés identique à celle de la protéine toxique pour le DPT (dite protéine de la bande 3 du Btt) trouvée chez Bacillus thuringiensis variété tenebrionis, tel que signalé par Perlak et coll. (1993). |
| E9 3' | 0,63 | Une région 3' non traduite de la petite sous-unité de ribulose-1, 5-bisphosphate carboxylase du gène E9 (rbcS) chez le poi (Coruzzi et coll., 1984), qui a pour fonction de terminer la transcription et de diriger la polyadénylation de l'ARN messager cryIIIA. |
| NOS 3' | 0,26 | Région 3' non traduite du gène de la nopaline synthase qui a pour fonction de terminer la transcription et de diriger la polyadénylation de l'ARNm du gène nptII (Depicker et coll., 1982; Bevan et coll., 1983). |
| nptII | 0,79 | Le gène isolé de Tn5 (Beck et coll., 1982) qui code pour la néomycine phosphotransférase type II. L'expression de ce gène chez les cellules végétales confère de la résistance à la kanamycine et sert de marqueur de sélection pour la transformation (Fraley et coll., 1983). |
| 35S | 0,32 | Promoteur 35S du virus de la mosaïque du chou-fleur (CaMV) (Gardner et coll., 1981; Sanders et coll., 1987). |
| LB | 0,45 | Un fragment de restriction du plasmide Ti de l'octopine, pTi15955, contenant les 24 pb de la limite gauche de l'ADN-T, a servi à terminer le transfert de l'ADN-T de la bactérie Agrobacterium tumefaciens au génome de la plante (Barker et coll., 1983). |
| ori V | 1,3 | Segment comportant l'origine de la réplication de la souche Agrobacterium tumefaciens ABI provenant du plasmide RK2 à large spectre d'hôtes (Stalker et coll., 1981). |
| ori-322/rop | 1,8 | Un segment de pBR322 qui assure l'origine de la réplication pour le maintien du plasmide PV-STBT02 chez E. coli, la réplication de la région de l'amorce (rop) et du site bom pour le transfert conjugationnel dans les cellules de Agrobacterium tumefaciens (Bolivar et coll., 1977; Sutcliffe, 1978). |
| aad | 0,93 | Fragment isolé du transposon Tn7 contenant un gène de 0,79 kb codant l'enzyme streptomycine adénylyltransférase et permettant de sélectionner les bactéries sur un milieu contenant de la spectinomycine ou de la streptomycine (Fling et coll., 1985). |
Notes de tableau
- Note de tableau 1
Les tailles sont approximatives.
Figure 1 : Exemple d'une carte détaillée d'un vecteur plasmidique
(extrait de la demande de l'APHIS no 94-257-01p)
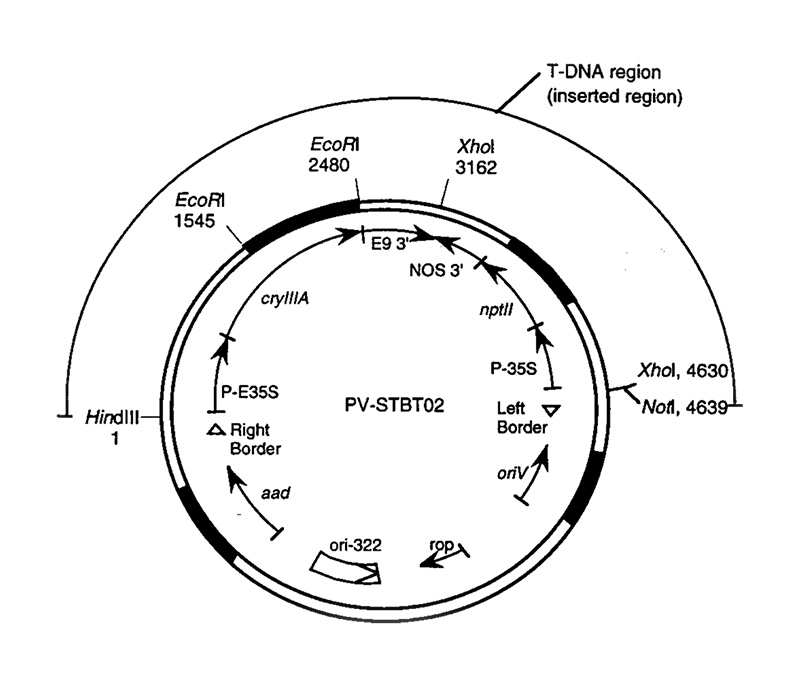
Description for images – Figure 1. Carte de vecteur plasmidique du PV-STBT02
Cette figure démontre les sites de restriction et leurs emplacements en paires de bases ayant été utilisés lors des analyses de transfert de Southern. La région de l'ADN-T est indiquée, de même que ses limites droite et gauche qui sont déterminées par des flèches ouvertes. Les régions noircies indiquent l'emplacement de l'homologie des sondes par PCR utilisées lors des analyses de Southern. On peut voir également les sites de restriction des enzymes de restriction HindIII, EcoRI, XhoI, et NotI.
Références
FAO/WHO (2000). Joint FAO/WHO Consultation on Foods Derived from Biotechnology: Safety aspects of genetically modified foods of plant origin. World Health Organization 29 May – 2 June 2000, WHO Headquarters, Geneva, Switzerland
FAO/WHO (2001). Joint FAO/WHO Consultation on Foods Derived from Biotechnology: Evaluation of the allergenicity of genetically modified foods, 22‑25 January 2001, Rome, Italy
OECD (1993). Safety evaluation of foods derived by modern biotechnology: concepts and principles. Organization for Economic Development and Cooperation, Paris.
2.8 Guide sur la transition d'une demande vers des données provenant d'une littérature publiquement accessible et des demandes d'aliments pour animaux précédemment approuvées
Les données à l'appui de l'efficacité ou l'innocuité d'un aliment pour animaux peuvent être fournies par le demandeur à partir d'études internes, de publications scientifiques évaluées par des pairs ou, dans certains cas, en se référant à des demandes antérieures de l'Agence canadienne d'inspection des aliments (ACIA). Lorsque les demandeurs se réfèrent à des données autres que celles provenant d'études internes complètes, une « transition » est nécessaire pour démontrer la pertinence de ces études pour le produit dans la demande actuelle.
Le cas échéant, une transition est effectuée pour appuyer les exigences en matière d'efficacité et/ou d'innocuité en vue de l'approbation et l'enregistrement d'un aliment à ingrédient unique ou de l'enregistrement d'aliments mélangés pour animaux. Les directives sur les exigences en matière d'information à l'appui de l'enregistrement ou l'approbation des aliments pour animaux se trouvent dans l'hyperlien suivant : « DR-1 Directives réglementaires : Procédures d'enregistrement et normes d'étiquetage ».
L'ACIA ne peut prendre en compte les données de la littérature scientifique examinée par des pairs ou les demandes antérieures que si les exigences de transition ci-dessous sont remplies :
- Exigences de transition des données accessibles au public
- Exigences de transition vers les données des demandes précédentes
- Exigences de transition vers des données appartenant à une entreprise tierce
A. Exigences de transition des données accessibles au public
Seule la littérature scientifique examinée par des pairs sera considérée comme acceptable en tant que source de données accessibles au public. L'ensemble des informations, données et résultats contenus dans l'article de recherche sera évalué et pris en compte lors de l'évaluation. L'article de recherche ne doit pas nécessairement être publié par le demandeur. Cependant, la pertinence de l'étude dans le contexte de l'aliment pour animaux à l'étude doit être expliquée dans la demande, comme il est décrit ci-dessous.
Pour chaque article scientifique utilisé pour la transition des données, le demandeur doit fournir une copie de l'article et un résumé qui comprend une explication de toutes les informations et tous les résultats pertinents. Ce résumé doit inclure une justification ou un raisonnement :
- démontrer l'équivalence de l'ingrédient ou du produit utilisé dans l'étude avec le produit examiné. Par exemple, la forme de l'ingrédient (physique, chimique ou biologique) et la méthode de traitement appliquée au produit utilisé dans l'étude doivent être équivalentes à celles de l'ingrédient ou du produit examiné. Si l'ingrédient ou le produit n'est pas identique, la justification de transition doit être suffisante pour permettre de tirer des conclusions sur l'aliment pour animaux faisant l'objet de la demande.
- le taux d'utilisation de l'ingrédient ou du produit dans l'étude publiée, comparé à celui de l'ingrédient ou du produit à l'étude, doit être :
- équivalent lorsqu'il est utilisé pour soutenir l'efficacité
- équivalent ou supérieur lorsqu'il est utilisé pour soutenir l'innocuité
- démontrer l'équivalence des animaux utilisés dans l'étude avec ceux destinés à être nourris avec l'ingrédient ou le produit examiné. Cela doit inclure une discussion sur l'espèce, le type et la phase de production des animaux dans l'étude publiée et la pertinence par rapport à l'espèce animale visée. Une justification scientifique de l'extrapolation inter ou intraespèce est requise. Une considération sera accordée à :
- la similitude physiologique entre les espèces (par exemple, la physiologie digestive et le métabolisme) et
- leur objectif de production (par exemple, la viande par rapport à la reproduction (c'est-à-dire la production de lait et d'œufs).
Par exemple, une étude sur les bovins de boucherie peut être utilisée pour soutenir des demandes d'aliments pour d'autres ruminants producteurs de viande. Néanmoins, elle peut ne pas être pertinente pour soutenir des demandes d'aliments pour des ruminants en lactation ou en reproduction et ne peut généralement pas être utilisée pour soutenir une demande d'aliment pour les animaux de ferme monogastriques.
La source des données issues de la littérature scientifique examinée par des pairs doit être citée dans la demande (auteur/source, année), et une liste de toutes les références doit être fournie. Chaque référence doit inclure les auteurs, le titre du document, la source, la date et les numéros des pages.
B. Exigences de transition vers les données des demandes précédentes
Les demandeurs peuvent également relier les données des demandes précédemment approuvées en faisant référence à leurs propres données qui ont été précédemment soumises et acceptées pour l'approbation ou l'enregistrement.
- Le demandeur doit inclure un résumé des données ainsi qu'une justification scientifique expliquant pourquoi les données d'une demande antérieure sont applicables à l'ingrédient ou au produit en cours d'examen.
- La transition des données d'une demande précédente sera considérée comme acceptable si les expériences ont été conçues et réalisées dans le même but que celui de la nouvelle demande ou, si ce n'est pas le cas, elles permettrait de tirer des conclusions sur l'aliment pour animaux en question.
- Le demandeur doit fournir des preuves pour démontrer que l'ingrédient ou le produit évalué précédemment est équivalent à l'ingrédient ou au produit en cours d'examen. Par exemple, la forme de l'ingrédient (physique et chimique), les procédés de fabrication et le taux d'utilisation de l'aliment pour animaux précédemment évalué doivent être pertinents pour l'aliment pour animaux à l'étude. S'ils ne sont pas identiques, la justification de transition doit être suffisante pour permettre de tirer des conclusions sur l'aliment pour animaux faisant l'objet de la demande.
- Pour que l'ACIA prenne en compte les données applicables de d'autres demandes, le demandeur peut:
- Fournir tous les renseignements de transition applicables à la nouvelle demande dans le dossier de demande actuel sous forme d'annexe, ou
- Fournir le numéro de référence ou le numéro d'enregistrement de l'aliment et la date d'enregistrement original correspondant à la demande pour laquelle les données originales ont été fournies afin que l'ACIA puisse les localiser efficacement.
C. Exigences de transition vers des données appartenant à une entreprise tierce
Le cas échéant, une demande concernant un ingrédient ou un produit pour animaux peut être reliée aux données soumises par une entreprise tierce qui a déjà obtenu une approbation ou un enregistrement pour un ingrédient ou un produit comparable ou, sous certaines conditions, pour le même ingrédient ou produit inclus dans la nouvelle demande. En plus des informations de la section B, le demandeur doit:
- fournir une attestation d'une personne ayant le pouvoir de signature de l'entreprise qui détient l'enregistrement ou l'approbation
- L'attestation de l'entreprise tierce doit indiquer qu'elle ne s'oppose pas à ce que son dossier et ses données soient utilisés par l'ACIA pour soutenir les exigences en matière de données pour l'approbation ou l'enregistrement des ingrédients ou produits pour animaux pour la demande actuelle.
- Lorsque les données d'une autre entreprise sont utilisées pour établir la transition et sont considérées comme des informations commerciales confidentielles :
- les données peuvent être fournies directement à l'ACIA par l'entreprise tierce, ou
- l'entreprise tierce peut fournir le numéro de référence de la demande originale ou le numéro d'enregistrement de l'aliment pour animaux et la date d'enregistrement originale correspondant à la demande pour laquelle les données originales ont été fournies afin que l'ACIA puisse la localiser efficacement.
Listes de contrôle
- Liste de contrôle pour la transition de la littérature scientifique évaluée par les pairs
- Liste de contrôle pour la transition vers les données d'une demande antérieure ou les informations d'une tierce partie
Liste de contrôle pour la transition de la littérature scientifique évaluée par les pairs
La liste de contrôle ci-dessous peut être utilisée pour vérifier que tous les aspects de la transition sont inclus dans une soumission chaque fois que la littérature scientifique évaluée par des pairs est utilisée pour fournir des informations pertinentes aux exigences de la soumission.
| Emplacement dans la soumission (page/nom du fichier) |
Contrôle ou S.O. | ||
|---|---|---|---|
| 1. | Fournir une citation de référence Auteurs. (Année) Titre. Titre du journal. Volume (numéro) : page-page Exemple : Hyde, M. L., M. R. Wilkens, and D. R. Fraser. (2019) In vivo |
||
| 2. | Une copie de la publication scientifique évaluée par les pairs a été incluse
|
||
| 3. | Un résumé des informations pertinentes de la publication en lien avec l'exigence de données qu'elle est censée soutenir a été fourni et répond aux points 4 à 6 ci-dessous | ||
| 4. | Information démontrant l'équivalence de l'ingrédient ou du produit utilisé dans l'étude avec le produit évalué.
|
||
| 5. | Le taux d'utilisation de l'ingrédient ou du produit dans l'étude publiée doit être comparé à celui de l'ingrédient ou du produit à l'étude et doit être:
|
||
| 6. | L'équivalence de l'animal utilisé dans l'étude et les animaux qui sont censés être nourris avec l'ingrédient ou le produit à l'étude, en tenant compte des éléments suivants :
Si nécessaire, l'extrapolation de la justification à des espèces physiologiquement apparentées et à des fins de production |
Liste de contrôle pour la transition vers les données d'une demande antérieure ou les informations d'une tierce partie
La liste de contrôle ci-dessous peut être utilisée pour vérifier que tous les aspects de la transition sont inclus dans une soumission chaque fois qu'un demandeur fait référence à des données précédemment soumises et acceptées pour une approbation ou un enregistrement afin de fournir des informations pertinentes en matière d'exigences de soumission.
| Éléments de justification de transition | Emplacement dans la soumission (page/nom du fichier) |
Contrôle ou S.O. | |
|---|---|---|---|
| 1. | Un résumé des données précédemment approuvées | ||
| 2. | Inclure une justification scientifique expliquant pourquoi les données d'une demande antérieure s'appliquent à l'ingrédient ou au produit en cours d'évaluation et répondre aux points 3 à 5 ci-dessous | ||
| 3. | Des informations indiquant que les expériences ont été conçues et réalisées dans le même but (y compris l'utilisation) que dans la nouvelle demande
|
||
| 4. | Fournir des preuves pour démontrer que l'ingrédient ou le produit évalué précédemment est équivalent à l'ingrédient ou au produit en cours d'évaluation
|
||
| 5. | L'équivalence de l'animal utilisé dans l'étude et les animaux qui sont censés être nourris avec l'ingrédient ou le produit à l'étude, en tenant compte des éléments suivants :
|
||
| 6. | Toutes les informations de transition qui s'appliqueraient à la nouvelle demande dans le dossier de demande actuel sous forme d'annexe
|
||
| 7. | Dans le cas d'une transition vers des données d'une tierce partie : Une attestation d'une personne ayant le pouvoir de signature de l'entreprise détenant l'enregistrement ou l'approbation est fournie et indique ce qui suit :
|
2.9 Flexibilité des données pour les paramètres de performance de production et les allégations associées
L'ACIA introduit des approches flexibles pour les données requises pour remplir la partie efficacité d'une demande préalable à la mise en marché. Ce document d'orientation explique la flexibilité accordée en ce qui concerne les études requises pour soutenir les allégations de performance de production.
Auparavant, pour faire une allégation de performance de production spécifique pour un aliment pour animaux, un demandeur devait fournir des données pour appuyer les allégations d'au moins trois études indépendantes par espèce et classe de production. Voici quelques exemples (liste non exhaustive) de paramètres spécifiques pour lesquels des allégations de performance de production peuvent être faites :
- efficacité alimentaire ou taux de conversion alimentaire
- taux d'ingestion d'aliments pour animaux ou de matières sèches
- croissance ou gain moyen quotidien
- production d'œufs
- production de lait
- performance de reproduction (retour à l'œstrus, % de gestation; % de mises bas)
- porcelets sevrés (nombre de porcelets sevrés; poids de la portée)
- proportion d'animaux en croissance en dessous du poids corporel cible
- poids de la carcasse; qualité de la carcasse et/ou de la viande
Il existe maintenant trois façons de gagner en flexibilité pour soutenir ces types d'allégations sans compromettre l'innocuité d'un produit.
- Combinaison de paramètres spécifiques pour faire une allégation générale de performance de production
- Extrapolation des données entre des espèces physiologiquement semblables
- Force de l'allégation – ajouter davantage de flexibilité avec la valeur p
Dans tous les cas, il incombe au demandeur de décrire clairement à l'ACIA comment ses données en matière d'efficacité utiliseront ces flexibilités. Cela signifie que le dossier de soumission doit comprendre un résumé détaillant tout lien entre les études soumises et les allégations proposées. En aucun cas, ces flexibilités ne peuvent être envisagées à la place de la soumission des études/données d'innocuité requises.
I. Combinaison de paramètres spécifiques pour faire une allégation générale de performance de production
La cohérence dans la déclaration ou l'importance des paramètres spécifiques dans différentes études (internes ou publiées) portant sur des espèces et/ou des classes de production d'animaux de ferme pertinentes peut rendre difficile le respect du seuil de trois études pour une allégation particulière. Cependant, il est maintenant possible de faire une allégation générale de performance de production. Lorsqu'au moins trois études indépendantes démontrent des paramètres bénéfiques significatifs, même s'ils sont différents, une allégation générale de performance de production peut être faite. Le tableau 1 présente quelques exemples de la manière dont les allégations spécifiques/générales peuvent être évaluées.
| Données fournies sur l'efficacité | Allégation |
|---|---|
Une demande pour un supplément d'aliment pour vaches laitières
|
Augmentation de la production de lait et du taux d'ingestion d'aliments chez les vaches laitières |
Une demande pour un supplément d'aliment pour vaches laitières
|
Augmentation de la production de lait chez les vaches laitières |
Une demande pour un supplément d'aliment pour vaches laitières
|
Augmentation des performances de production chez les vaches laitières |
Une demande pour un supplément d'aliment pour les porcs en croissance
|
Augmentation du gain moyen quotidien et du taux d'ingestion d'aliments chez les porcs en croissance |
Une demande pour un supplément d'aliment pour les porcs en croissance
|
Augmentation du gain moyen quotidien chez les porcs en croissance |
Une demande pour un supplément d'aliment pour les porcs en croissance
|
Augmentation des performances de production chez les porcs en croissance |
II. Extrapolation des données entre des espèces physiologiquement semblables
Une approche pour certaines allégations relatives aux aliments pour animaux où l'extrapolation des données d'efficacité à partir de certaines espèces à d'autres espèces physiologiquement apparentées pourrait être utilisée afin de réduire le nombre total d'études nécessaires pour étayer une allégation pour plusieurs espèces physiologiquement similaires.
En général, les conclusions tirées des études sur les animaux élevés pour la viande peuvent être étendues aux animaux de la même espèce élevés pour la reproduction, mais avant que la reproduction n'ait lieu (par exemple, des poulets de chair aux poulets de remplacement élevés pour la ponte/la reproduction (pré-ponte/poules de remplacement avant la reproduction), des bovins de boucherie aux génisses de remplacement destinées à la reproduction ou à la production laitière, mais avant que la reproduction ou la production de lait n'ait lieu). Les données sur l'efficacité ne peuvent généralement pas être extrapolées entre les catégories de la même espèce à différentes classes de production (par exemple, des poulets de chair aux poules pondeuses ou reproductrices).
Lorsqu'une demande d'aliments pour animaux couvre plusieurs espèces cibles dans la même classe de production, il est reconnu qu'il peut être irréaliste de s'attendre à des études sur toutes les espèces cibles potentielles pour lesquelles une demande est faite. Par conséquent, l'extrapolation interspécifique des données peut être appliquée.
En principe, les données peuvent être extrapolées entre des espèces physiologiquement semblables (tableau 2) dans la même classe de production. Le degré de parenté physiologique des espèces est estimé principalement en termes de physiologie et fonction gastro-intestinale. Les similitudes dans le métabolisme sont également prises en compte. L'extrapolation interspécifique peut être appliquée dans les cas où :
- les animaux sont élevés dans le même but, c'est-à-dire la production de viande ou la reproduction (y compris la production de lait ou d'œufs)
- le mode d'action du produit peut raisonnablement être présumé le même entre les espèces;
- le ou les effets allégués sont les mêmes
- la concentration efficace minimale chez les espèce physiologiquement apparentées doit être la même que celle établie chez l'espèce/la catégorie à partir de laquelle les données ont été extrapolées
| Principales espèces | Caractéristiques | Espèces physiologiquement apparentées |
|---|---|---|
| Poulets de chair | Poulets élevés pour la production de viande | Autres volailles (par exemple, dindes, canards, oies, faisans, cailles, pintades, etc.) élevées pour la viande et volailles de ponte/de reproduction avant la ponte (poules de remplacement avant la reproduction/pré-ponte) |
| Poules pondeuses | Volailles femelles productives détenues à des fins de production d'œufs | Autres volailles pondeuses utilisées pour la production d'œufs et la reproduction (par exemple, dindes, canards, oies, faisans, cailles, pintades, etc.) |
| Porcelets sevrés | Jeunes animaux ayant terminé la période d'allaitement | Autres Suidae sevrés |
| Porcs en croissance | Animaux destinés à la production de viande jusqu'au jour du transport à l'abattoir | Autres Suidae en croissance |
| Truies | Animaux femelles ayant été inséminées ou accouplées | Autres Suidae reproductrices |
| Veaux | Veaux élevés pour reproduction, la production de viande de veau ou de viande bovine avant la rumination | Autres jeunes ruminants avant la rumination (par exemple, moutons (agneaux), chèvres (chevreaux), buffle) |
| Bovins en croissance | Bovins ayant terminé la période de sevrage avec un rumen pleinement développé | Autres ruminants en croissance (par exemple, moutons, chèvres, buffles) |
| Vache laitière | Bovin femelle en lactation ou pré-partum | Autres ruminants laitiers (par exemple, chèvre, mouton, buffle) au stade de développement correspondant |
| Saumon | Salmonidés en croissance | Autres salmonidés (par exemple, la truite, l'omble chevalier) |
| Chevaux | Chevaux élevés pour la performance ou la production de viande | Autres Equidae |
| Juments reproductrices | Juments qui sont devenues gestantes au moins une fois | Autres Equidae reproductrices |
| Lapins | Lapins élevés pour la reproduction ou la production de viande | Autres Leporidae |
| Lapines reproductrices | Lapines qui sont devenues gestantes au moins une fois | Autres Leporidae reproductrices |
Lorsque la demande couvre plusieurs espèces/classes, le nombre minimum d'études indépendantes montrant l'effet recherché est indiqué dans le tableau 3. Pour les demandes couvrant toutes les espèces animales productrices d'aliments, l'efficacité doit être démontrée chez des espèces ayant des systèmes digestifs différents. Par conséquent, des études doivent être fournies pour étayer l'efficacité pour tous les porcs, toutes les volailles, tous les ruminants et tous les poissons à nageoires, selon le tableau 3. Les entreprises peuvent demander à ce que les demandes soient étendues au fil du temps pour ajouter des espèces/classes supplémentaires d'animaux de ferme au fur et à mesure que les données deviennent disponibles.
| Demandes pour | Nombre d'études requises et espèces |
|---|---|
| Toutes les espèces de viande et de volaille en croissance | 3 pour les poulets de chair Note de tableau a |
| Toutes les espèces de volailles pondeuses et reproductrices | 3 pour les poules pondeuses Note de tableau a |
| Toutes les espèces de volailles | 3 pour les poulets élevés pour la viande Note de tableau a + 3 pour les poules pondeuses Note de tableau a |
| Tous les porcs en croissance | 3 pour les porcelets sevrés Note de tableau a + 3 pour les porcs en croissance Note de tableau a |
| Tous les porcs | 3 pour les porcelets sevrés Note de tableau a + 3 pour les truies Note de tableau a |
| Tous les ruminants en croissance (voir ci-dessous) | 3 pour les veaux (pré-ruminants) Note de tableau a + 3 pour les bovins en croissance Note de tableau a |
| Tous les ruminants | 3 pour les veaux Note de tableau a + 3 pour les vaches Note de tableau a |
| Tous les poissons à nageoires | 3 pour les salmonidés + 3 pour (1 chacune) les autres espèces |
| Tous les chevaux | 3 couvrant à la fois les animaux en croissance et les animaux reproducteurs |
| Tous les lapins | 3 couvrant à la fois les animaux en croissance et les animaux reproducteurs |
III. Force de l'allégation – ajouter davantage de flexibilité avec la valeur p
Historiquement, l'ACIA a suivi la norme utilisée par les revues scientifiques évaluées par les pairs pour la recherche lors de la définition de la signification statistique p ≤ 0,05 (α=0,05). La prise en compte des points suivants permettra une flexibilité dans le degré de signification et une réduction de la spécificité réduite des paramètres d'évaluation et permettra une approche prévisible de la force de l'allégation.
- Une signification statistique à p ≤ 0,05 dans chacune des trois études permettra d'établir des allégations définitives.
- Les revues scientifiques impliquées dans la science animale permettent aux chercheurs de caractériser les résultats avec 0,05 < p ≤ 0,10 comme une ou des tendances. Ces résultats permettront de formuler des allégations moins définies faisant usage du terme « peut ».
- La flexibilité offerte par la force de l'allégation peut être renforcée par la flexibilité offerte par la combinaison de paramètres de production spécifiques pour faire une allégation générale de performance de production, comme indiqué dans la section I ci-dessus.
| Valeur p | Trois études pour des paramètres spécifiques de performance de production | Trois études avec différents paramètres de performance de production (voir section I ci-dessus) |
|---|---|---|
| p ≤ 0,05 | Améliore le paramètre spécifique | Améliore la performance de production |
| 0,05 < p ≤ 0,10 | Peut améliorer le paramètre spécifiques | Peut améliorer la performance de production |
| p > 0,10 | Non acceptable | Non acceptable |
| Aperçu de l'étude | Valeurs p | Allégation |
|---|---|---|
| 3 études montrant une amélioration du taux de conversion chez les bovins de boucherie | Toutes les études p ≤ 0,05 | Améliore le taux de conversion chez les bovins de boucherie |
| 3 études montrant une augmentation du taux de d'ingestion d'aliments chez les porcs en croissance et de finition | Toutes les études p ≤ 0,10 (certaines pourraient être ≤ 0,05) | Peut augmenter le taux d'ingestion d'aliments chez les porcs en croissance et de finition |
| 2 études montrant une augmentation du gain journalier chez des porcs en croissance, et 1 étude montrant une augmentation du taux d'ingestion d'aliments chez les porcs en croissance |
Toutes les études p ≤ 0,05 | Améliore la performance de production des porcs en croissance |
| 2 études montrant une augmentation du gain journalier chez les bovins de boucherie, et 1 étude montrant une augmentation du taux d'ingestion d'aliments chez les bovins de boucherie |
Toutes les études p ≤ 0,10 | Peut améliorer la performance de production des bovins de boucherie |
| 3 études montrant une augmentation du taux d'ingestion d'aliments chez les poules pondeuses | Une étude p ≤ 0,05 Deux études p ≤ 0,10 |
Peut augmenter le taux d'ingestion d'aliments chez les poules pondeuses |
| 2 études montrant une augmentation du gain journalier, et 1 étude montrant une augmentation du taux d'ingestion d'aliments chez les porcs en croissance. |
Deux études p ≤ 0,05 Une étude p ≤ 0,10 |
Peut améliorer la performance de production des porcs en croissance |
- Date de modification :